下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是
下列有关电解质溶液中微粒的物质的量浓度关系正确的是()
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液pH=7, c(Na+)=0.1 mol·L-1:c(CH3COOH) >c(Na+) >c(CH3COO-)>c(H+)=c(OH-) |
下列各组离子能在指定环境中大 量共存的是()
量共存的是()
| A.在C(HCO3—)=0.1mol/L的溶液中NH4+、Al3+、Cl-、NO3- |
| B.在由水电离出的C(H+)=1×10-12mol/L的溶液中AlO2-、HCO3-、Na+、SO42- |
| C.在使红色石蕊试纸变蓝的溶液中SO32-、CO32-、Na+、K+ |
| D.pH=1的溶液中Mg2+、Fe2+、NO3-、Cl- |
下列反应的离子方程式书写正确的是()
A.硫酸铝溶液中加入 过量氨水 Al3++3OH-=Al(OH)3↓ 过量氨水 Al3++3OH-=Al(OH)3↓ |
B.电解饱和食盐水 2Cl-+2H+ H2↑+C12↑ H2↑+C12↑ |
| C.在稀氨水中通入过量CO2 NH3·H2O+CO2 = NH4+ + HCO3- |
D.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶 液 : Fe2++2H++H2O2 液 : Fe2++2H++H2O2 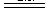 Fe3++2H2O Fe3++2H2O |
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是()
| A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
在100mL0.1mol/L 的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用方法是( )
A加热。B加入0.1mol/L 的醋酸溶液100mL。
C加入少量的0.5mol/L的硫酸。 D加入少量1mol/L 的NaOH溶液。