甲醇(CH3OH)燃料电池可用作电动汽车电源,下图为电池示意图。在电池的一极通入甲醇,另一极通入氧气,工作时H+由负极移向正极。下列叙述不正确的是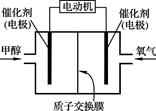
| A.外电路通过0.6 mol电子时,理论上消耗甲醇3.2 g |
| B.通甲醇一端为负极 |
| C.正极反应为:O2+4H++4e-= 2H2O |
| D.负极反应为:CH3OH+H2O+6e-= CO2↑+6H+ |
下列描述中,不符合生产实际的是
| A.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| D.在镀件上电镀锌,用锌作阳极 |
如图所示,利用2Ag + Cl2 = 2AgCl设计的原电池可测量空气中Cl2的含量(原电池的电解质是含有自由移动Ag+的固体物质)。下列分析不正确的是
| A.空气中c(Cl2)越大,Ag极消耗速率越快 |
| B.Ag+向Pt电极移动 |
| C.电子由Ag电极经外电路流向Pt电极 |
| D.Ag电极上发生了还原反应 |
已知I2(g)+H2(g) 2HI(g)△H=-QkJ/mol(Q>0),H-H键能为akJ/mol,H-I键能为bkJ/mol,则I-I键能是
2HI(g)△H=-QkJ/mol(Q>0),H-H键能为akJ/mol,H-I键能为bkJ/mol,则I-I键能是
| A.b+Q-a kJ/mol |
| B.2b-Q-a kJ/mol |
| C.2b+Q-a kJ/mol |
| D.b-Q+a kJ/mol |
反应3A(g)+B(g) 2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是
A.v(A)=1.5 mol·L-1·s-1
B.v(C)=0.5 mol·L-1·s-1
C.v(D)=0.6 mol·L-1·s-1
D.v(B)=0.4 mol·L-1·s-1
下列有关说法不正确的是
| A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈 |
| B.手机上用的锂离子电池属于二次电池 |
| C.燃料电池能把化学能转化成电能 |
| D.已知反应2CO(g)=2C(s)+O2(g)的△H>0、△S<0,那么高温下可自发进行 |