已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 |
CH3COOH |
HCN |
H2CO3 |
| 电离平衡常数(25 ℃) |
1.8×l0-5 |
4.9×l0-10 |
K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L-1 HCN溶液与a mol·L-1 NaOH溶液等体积混合后,所得溶液显碱性(pH>7),则c (OH-)>c(H+)、c(Na+)>c(CN-)
C.冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定有c(Na+)+c(H+) = c(OH-)+c(HCO3-)+c(CO32-)
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量小 |
| C.甲的摩尔体积比乙的摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量小 |
把500mL有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为
| A.0.1(b-2a)mol/L | B.10(2a -b)mol/L |
| C.10(b-2a)mol/L | D.10(b-a)mol/L |
取a g某物质在足量氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后固体的质量恰好也增加了a g。下列物质中不能满足上述结果的是
| A.H2 | B.CO | C.C6H12O6 | D.C12H22O11 |
某合作学习小组讨论辨析以下说法:①粗盐和酸雨都是混合物;②沼气和水煤气都是可再生能源;③冰和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤盐酸和食醋既是化合物又是酸;⑥纯碱和熟石灰都是碱;⑦豆浆和雾都是胶体。其中正确的是
| A.①②③④ | B.①②⑤⑥ | C.③⑤⑥⑦ | D.①③④⑦ |
下列化学反应的离子方程式正确的是
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH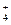 +HCO +HCO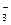 |
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3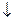 +2HClO +2HClO |
| C.向Ba(OH)2溶液中加入少量的NaHSO3溶液 2HSO3-+Ba2++2OH-  BaSO3↓+SO32-+2H2O BaSO3↓+SO32-+2H2O |
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO =CaSO4 =CaSO4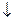 +H2O +H2O |