为测定实验室中某过氧化氢溶液的溶质质量分数,小明取25.0g过氧化氢溶液放入烧杯中,然后进行如图所示的实验,反应的化学方程式是2H2O2 O2↑+2H2O.请计算:
O2↑+2H2O.请计算: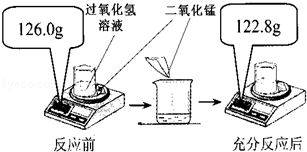
(1)反应后产生氧气的质量为 g。
(2)此过氧化氢溶液的溶质质量分数。
实验室有盐酸、白醋、柠檬酸三种溶液,回答下列问题:
(1)向三氧化二铁(红棕色固体)中放入足量盐酸,充分反应后,观察到的现象,反应的化学方程式是。
(2)白醋、柠檬酸溶液也能与三氧化二铁发生类似反应,说明白醋、柠檬酸溶液和盐酸中都含有的离子是。
(3)理论上溶解3.2 g三氧化二铁,需要36.5%的盐酸多少克?(列式计算)
为测定某纯碱(Na2CO3)样品中(含有少量的氯化钠杂质)碳酸钠的质量分数,现称取6 g试样放在烧杯中并滴入稀盐酸,当稀盐酸滴加至36.5 g时,烧杯内溶液的总质量为40.3 g(产生的气体全部逸出)。产生气体的质量与滴入稀盐酸的质量关系如图所示,试计算:
(1)A点产生气体的质量为__________;
(2)试样中碳酸钠的质量分数(结果精确到0.1%);
(3)B点时,烧杯内溶液中溶质的化学式为_______________。
我国约在南北朝时就开始冶炼黄铜。黄铜是铜和锌的合金(Cu-Zn),它可用来制造机器、电器零件及日用品。为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将15 mL稀盐酸分三次加入到5 g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
| 第一次 |
第二次 |
第三次 |
|
| 加入稀盐酸的体积(mL) |
5 |
5 |
5 |
| 生成氢气的质量(g) |
0.04 |
m |
0.02 |
试求:(1)m=________________;
(2)此黄铜样品中锌的质量分数是多少?
某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。
试计算:
(1)用10克30%的浓盐酸配制成2%的稀盐酸,需加水多少克?
(2)取20克废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3克,求废水中氢氧化钾的质量分数。
请根据下图所示实验过程和数据,计算反应后溶液中H2SO4的质量。