中学化学中常见的几种物质存在下图所示的转化关系。其中,A是一种黑色粉末状固体,C是一种黄绿色气体,实验室中常用E溶液吸收多余的C。(图中部分产物和反应条件已略去)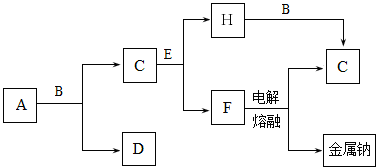
回答下列问题:
(1)写出A与B的浓溶液反应的化学方程式 。
(2)固体E中含有化学键的类型是 ,C与E反应的离子方程式为 。
(3)将B的浓溶液与H的浓溶液混合,立即产生大量气体C,该反应的离子方程式为 。
(4)某课外小组的同学用E溶液吸收C,利用下图所示装置向吸收液中持续通入SO2气体。
实验过程中观察到如下现象:
①开始时,溶液上方出现白雾,试纸a变红。甲同学认为是HCl使a变红,乙同学不同意甲的观点,乙同学的认为使a变红的是 (写出一种即可)。
②片刻后,溶液上方出现黄绿色气体,试纸b变蓝。用离子方程式解释b变蓝的原因 。
③最终试纸b褪色。同学们认为可能的原因有两种:一是I2有还原性,黄绿色气体等物质将其氧化成
IO3-,从而使蓝色消失;二是 。
(1)0.1 mol某烃在足量的氧气中完全燃烧,生成的CO2和水各0.6 mol,则该烃的分子式为。
(2)若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃属于烃,结构简式为,名称是,该烃的二氯代物有种。
(3)若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2,2—二甲基丁烷,则此烃属于烃,结构简式为, 名称是;
核磁共振氢谱有个吸收峰,其面积比是。
下列物质中,与该烃互为同系物的是(填序号)_________,互为同分异构体的是________。
① CH3CH===CHCH3 ② CH2===CHC(CH3)3
③ CH3CH2CH===CHCH2CH3 ④(CH3)2CH(CH2)2CH3
炒过菜的铁锅未及时洗净(菜的残液中含NaCl),第二天铁锅便出现红棕色锈斑(Fe2O3·xH2O)。
请完成下列问题:
(1)该腐蚀属于腐蚀____________(填“化学”或“电化学”)。
(2)正极的电极反应式是__________________________。
(3)用电极反应式、离子反应式、化学方程式表示铁锈的形成过程。
如右图所示,在大试管里固定一段光亮无锈的弯成螺旋状的铁丝,把试管倒插入水中,把这个装置这样放置一周后,观察到铁丝发生的变化是_____________________,试用电极反应式和必要的化学方程式表示该过程:______________,_______________。试管里的水面会上升,最终上升高度约为_____________,原因是(用必要的文字及反应式表示)____________。
我国首创以铝—空气—海水电池作为能源的新型海水标志灯,它以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。则该电源负极材料为_______________,正极材料为_______________,正极反应式为:______________________,负极反应式为:_________________________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请完成以下问题: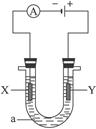
(1)若X、Y者是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为_____________________。在X极附近观察到的现象是______________________。
②Y电极上的电极反应式为__________________________________,检验该电极反应产物的方法是______________________________。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是______________,电极反应式为______________________。
②Y电极的材料是______________,电极反应式为______________________。(说明:杂质发生的电极反应不必写出)