设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A.常温下,23g NO2含有NA个氧原子 |
| B.1 L 0.1mol•L-1的氨水含有0.1NA个OH― |
| C.标准状况下,22.4 L CCl4含有NA 个CCl4分子 |
| D.1molFe2+与足量的H2O2溶液反应,转移2NA个电子 |
已知常温下在溶液中可发生如下两个离子反应
Ce4++Fe2+= Fe3++Ce3+ Sn2++2Fe3+ = 2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
| A.Sn2+、Fe2+、Ce3+ | B.Sn2+、Ce3+、Fe2+ |
| C.Ce3+、Fe2+、Sn2+ | D.Fe3+、Sn2+、Ce3+ |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一,下列说法正确的是
| A.原子半径的大小顺序:rY> rX >rQ>rW |
| B.X、Y的最高价氧化物的水化物之间不能发生反应 |
| C.Z元素的氢化物稳定性大于W元素的氢化物稳定性 |
| D.元素Q和Z能形成QZ2型的共价化合物 |
下列图示实验合理的是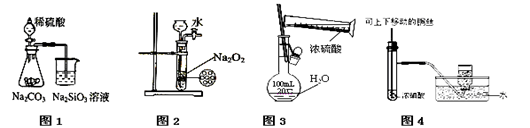
| A.图4为用浓硝酸溶液与铜反应制备并收集少量NO2 |
| B.图2为制备少量氧气 |
| C.图3为配制一定物质的量浓度的硫酸溶液 |
| D.图1为证明非金属性强弱:S>C>Si |
下列有关溶液组成的描述合理的是
| A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2- |
| B.酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| C.0.1 mol·L-1NaOH溶液大量存在:K+、Na+、SO42-、CO32- |
| D.无色透明溶液中大量存在:K+、Cu2+、SO42-、Na+ |
若NA表示阿伏加德罗常数,下列说法中正确的是
| A.16 g CH4与18 g NH4+所含质子数相等 |
| B.常温下,5.6g 铁钉与足量浓硝酸反应,转移的电子数为0.3 NA |
| C.1L 0.5 mol·L-1 Na2CO3溶液中,阴阳离子总数为1.5 NA |
| D.常温常压下,11g CO2气体中所含的分子数为0.25NA |