某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
①检查气体发生装置A的气密性的操作是 。
②整套实验装置存在一处明显的不足,请指出: 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:
,
请设计简单实验证明上述解释: 。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因: 。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为 。
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式:。
(2)收集氨气应使用法。
(3)要得到干燥的氨气可选用下列做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
(4)用图1装置进行喷泉实验,烧瓶已装满干燥氨气,引发水上喷的操作是。该实验的原理是。
(5)如果只提供如图2的装置,请举例说明引发喷泉法。
实验室需要配制2.0mol·L-1的NaCl溶液500 ml 。
(1) 本实验所必需的仪器有托盘天平(精确到0.1g)、药匙、烧杯、量筒、玻璃棒、胶头滴管、以及等质量的两片滤纸。
(2)某学生在摇匀后发现液面低于刻度线再加水,会导致结果(填“偏高”、“偏低”、“无影响”)。
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗液体未流下,你认为原因可能是
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
MnCl2+Cl2↑+2H2O请指出该反应中的液体反应物在反应中所表现出的化学性质:
__________________________________________________________________;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_________________________,D:____________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl 2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象那样。请你分析该现象的原因(用化学方程式表示)
(1)下图为常见仪器的部分结构(有的仪器被放大)A图中液面所示溶液的体积为mL,用上述四种仪器中的某种测量一液体的体积,平视时读数为N mL,仰视时读数为M mL,若M>N,则所使用的仪器是____(填字母标号)。
(2)在化学分析中,常需用KMnO4标准溶液,由于KMnO4晶体在室温下不太稳定,因而很难直接配制准确物质的量浓度的KMnO4溶液。实验室一般先称取一定质量的KMnO4晶体,粗配成大致浓度的KMnO4溶液,再用性质稳定、相对分子质量较大的基准物质草酸钠[Mr(Na2C2O4)=134.0]对粗配的KMnO4溶液进行标定,测出所配制的KMnO4溶液的准确浓度,反应原理为:5C2O42-+2MnO4-+16H+→10CO2↑+2Mn2++8H2O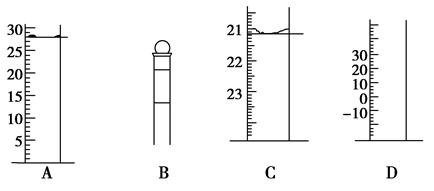
以下是标定KMnO4溶液的实验步骤:
步骤一:先粗配浓度约为0.15mol·L-1的高锰酸钾溶液500 mL。
步骤二:准确称取Na2C2O4固体m g放入锥形瓶中,用蒸馏水溶解并加稀硫酸酸化,加热至70~80℃,用步骤一所配高锰酸钾溶液进行滴定。记录相关数据。
步骤三:。
步骤四:计算得高锰酸钾的物质的量浓度。试回答下列问题:
①该滴定实验(“需要”或“不需要”)加指示剂。
②步骤二中滴定操作图示正确的是__________(填编号)。
③步骤二的滴定过程温度变化并不明显,但操作过程中发现前一阶段溶液褪色较慢,中间阶段褪色明显变快,最后阶段褪色又变慢。试根据影响化学反应速率的条件分析,溶液褪色明显变快的原因可能是_______,最后又变慢的原因是。④请写出步骤三的操作内容。⑤若m的平均数值为1.340g,滴定的KMnO4溶液平均用量为25.00mL,则KMnO4溶液的浓度为mol·L-1。
请回答有关下列五种气体:H2、O2、NO、NH3、NO2的问 题。
I.(1)与制取O2的发生装置相同的是;______________只能用一种方法收集的是______________________________
(2)以上气体制备反应中,有一反应在原理上与其它反应都不能归为同一类型,请写出实验室制取该气体的方程式_________________________________
II. 用右图装置进行喷泉实验(图中夹持装置均已略去)。
(1)若用图1装置进行喷泉实验,上部烧瓶已装满干燥的氨气,引发水上喷的操作是_____________________该实验的原理是______________________________________
(2)若用图2的装置,请举一例说明引发喷泉的方法___________________________
III:若用同一烧瓶分别充满如下气体:① HCl② NH3③ NO2进行喷泉实验,实验后烧瓶内溶液液面的高度关系为____________________________ (用序号和“>,<或=”表示,下同),所得溶液物质的量浓度大小关系为 ____________________________ 。