高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)仪器e的名称为____________,装置A中f管的作用是_______________________________________,其中发生反应的离子方程式为_____ ____________________________________ _______。
(2)装置B中的试剂是____________。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
| 方案 |
不足之处 |
| 甲 |
|
| 乙 |
|
(4)在上述(3)的评价基础上,请设计一个合理方案:___________ ________ 。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下: 
⑴指出提取碘的过程中有关的实验操作名称:①;④。
写出过程②中有关反应的离子方程式。
⑵现有下列实验仪器:A.烧杯 B.漏斗 C.表面皿 D.分液漏斗E.酒精灯
步骤①中必须用到的有(填序号),还缺少的玻璃仪器有;
(3) 步骤③中不可选用的有机试剂是。
A.汽油. B.苯C.酒精D.四氯化碳
⑷步骤③的实验操作可分解为如下几步:(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;(B)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞;(C)检验分液漏斗活塞和上口的玻璃塞是否漏液; (D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; (E)旋开活塞,用烧怀接收溶液;(F)将分液漏斗上口倒出上层水溶液;(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;(H)静置,分层; 就此实验,完成下列填空:
①正确操作步骤的顺序是:(用上述各操的编号字母填写)
→→→A→G→→E→F
②上述(E)步骤的操作中应注意
上述(G)步骤操作的目的是
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法。
如下图所示实验室制取酚醛树脂的装置,按要求填写下列空白:
(1)长玻璃管的作用除导气连通外还有。
(2)此反应需水浴加热,为什么不用温度计控制水浴温度?
(3)写出实验室制取酚醛树脂的化学方程式(有机物用结构简式):
。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:在大试管中先加入,然后边摇动试管边慢慢加入,待稍冷却后再加入乙酸。
(3)浓硫酸的作用是:① ;② ,
(4)饱和碳酸钠溶液的主要作用是①
②。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为;
(3)C装置中的反应的化学方程式为。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl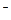 、CO32-、OH
、CO32-、OH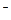 和SO
和SO 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
 预期现象和结论 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 mol L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 |
|
| 步骤2:向A试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |
Ⅰ、 四氯化钛是无色液体,沸点为136℃。它极易水解,遇空气中水蒸气即产生“白烟”(TiCl4+H2O=TiOCl2+2HCl↑)。在650℃~850℃下,将氯气通过二氧化钛和炭粉的混合物可得到四氯化钛和一种有毒气体。下图是某科研小组制备TiCl4的反应装置:
其主要操作步骤如下:
①连接好整套装置,在通Cl2前先通入CO2气体并持续一段时间;
②当锥形瓶中TiCl4的量不再增加时,停止加热,从侧管中改通CO2气体直到电炉中的瓷管冷却为止;
③将TiO2、炭粉混合均匀后,装入管式电炉中;
④将电炉升温到800℃,一段时间后改通Cl2,同时在冷凝管中通冷凝水。
试回答下列问题:
(1)正确的操作顺序为(填序号) ;
(2)装置A中的反应的离子方程式为;
(3)C装置中的反应的化学方程式为。
Ⅱ、若该科研小组将刚吸收过少量SO2的NaOH溶液注入装置E对上述实验的尾气进行吸收处理,则吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl 、CO32-、OH
、CO32-、OH 和SO
和SO 。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
。请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑盐类的水解).
(1)提出合理假设:
假设1:只存在SO32-;
假设2:既不存在SO32-也不存在ClO-;
假设3:。
(2)设计实验方案,进行实验。请写出实验步骤以及预期现象和结论。限选实验试剂:
a.3mo l L-1 H2SO4 b.0.01mol
L-1 H2SO4 b.0.01mol L-1 KMnO4 c.1mol
L-1 KMnO4 c.1mol L-1 BaCl2
L-1 BaCl2
d.淀粉—KI溶液 e.酚酞试剂 f.品红溶液
| 实验步骤 |
 预期现象和结论 预期现象和结论 |
步骤1:取少量吸收液于试管中,滴加3 mol L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中。 |
|
| 步骤2:向A试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设1成立。 否则,则假设2或3成立。 |
| 步骤3:向B试管中滴加1~2滴 (填序号)。 |
若溶液 ,则假设3成立。 否则,结合步骤2,则假设2成立。 |