把VL含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含bmolBaCl2的溶液恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含amolNaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
A.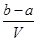 mol·Lˉ1 mol·Lˉ1 |
B. mol·Lˉ1 mol·Lˉ1 |
C.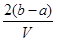 mol·Lˉ1 mol·Lˉ1 |
D. mol·Lˉ1 mol·Lˉ1 |
下列有关纯碱的分类,不正确的是
| A.碱 | B.盐 | C.钠盐 | D.碳酸盐 |
下列说法正确的是
| A.1mol任何物质都含有阿伏加德罗常数个原子 |
| B.CO2的摩尔质量为44g |
| C.标准状况下,1mol任何物质其体积都约为22.4L |
| D.同温同压下,相同体积的任何气体所含分子数相同 |
下列有关物质的保存方法,正确的是
| A.漂白粉存放在敞口容器中 | B.氢氟酸通常保存在棕色玻璃试剂瓶中 |
| C.少量的钠保存在煤油中 | D.氢氧化钠溶液用带磨口玻璃塞的普通试剂瓶贮存 |
从溴水中分离溴,下列物质不能作为萃取剂的是
| A.汽油 | B.苯 | C.乙醇 | D.四氯化碳 |
下列物质中,属于电解质的是
| A.NaOH | B.CO2 | C.氨水 | D.Cu |