工业上用白云石制备高纯氧化镁的工艺流程如下:
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
(1)为了提高白云石的煅烧效果,可以采取的措施是 。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 。
| A.蒸发皿 | B.坩埚 | C.泥三角 | D.石棉网 |
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示,pH过高会导致镁浸率降低,其原因为 ,pH过低对产品影响是 。
(3)从溶液中获得CaSO4·2H2O的操作是蒸发浓缩、 、过滤、洗涤、干燥。
(4)写出沉淀反应中的离子方程式: 。检验沉淀是否洗净的方法是: 。
(5)沉淀反应过程中,温度对产品的纯度也有一定的影响。如图为反应温度对氧化镁纯度的影响。最终确定本反应的适宜温度为 。
高锰酸钾是强氧化剂,它的用途遍布各个行业。
(1)工业上由软锰矿(主要成分为MnO2)生产髙锰酸钾分为两个步骤。
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4),该反应的化学方程式是______________。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在_______(填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是_______。
(2)某研究小组用工业生产高锰酸钾产生的废渣——猛泥(含K2MnO4、MnO2及Pb、Ca等元素)和乳钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
③轧钢废酸中Fe2+的作用是______________。
④操作I、操作II、操作III的名称是_______。
⑤溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是_______。
⑥若固体C中不含CaCO3,则溶液D中 <_______。
<_______。
[已知:Ksp(MnCO3)=1×10—11,Ksp(CaCO3)=5×10—9]
下表所列是元素周期表部分短周期的主族元素
| W |
X |
Y |
||
| R |
Z |
已知R为地壳中含量最多的金属元素。
(1)写出Z的原子结构示意图________。
(2)W与氢原子形成6原子分子的结构简式_______。
(3)超细RX粉末被应用于大规模集成电路领域。其制作原理为R2Y3、X2、W在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______。
(4)X最高价氧化物对应水化物与X气态氢化物反应的生成物溶于水中,所得溶液离子浓度从大到小的顺序是_______。
(5)火箭发动机的燃料胼(N2H4)与氧化剂N2O4反应生成N2和水蒸气。
已知①N2(g)+2O2(g)=N2O4(l)△H1=—195kJ•mol—1
②N2H4(l) +O2(g)=N2(g)+2H2O(g)△H2=—534.2kJ•mol—1
写出肼和N2O4反应的热化学方程式______________。
(6)温度为T时,向2.0L恒容密闭容器中充入1.00 mol PCl5,反应PCl5(g)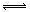 PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g),经过一段时间(t)后达到平衡。反应过程中测定的部分数据见下表:
| t/s |
0 |
50 |
150 |
250 |
350 |
| n(PCl3)/mol |
0 |
0.16 |
0.19 |
0.20 |
0.20 |
相同温度下,起始时向容器中充入1.00 mol PC15、0.20 mol PCl3和0.40 mol Cl2,反应达到平衡前v(正) _______v(逆)(填“>”或“=”或“<”);原因是_______。
莽草酸(C7H10O5)可有效对付致命的H5N1型禽流感病毒的药物“达菲”的重要成分,它可从中药八角茴香中提取得到。右图是以莽草酸为原料合成某些物质的路线: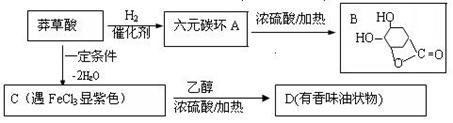
根据上图回答下列问题:
(1)A中含有的两种含氧官能团分别是_____________________
(2)已知烯醇式结构(C=C-OH)不能稳定存在、则莽草酸的结构简式为。
(3)莽草酸→C的反应类型是。
(4)写出C→D的化学反应方程式。
(5)与C具有相同官能团的同分异构体(含C)共有种。
(1)铬的外围电子排布式是,与铬同周期,最外层有3个未成对电子数的主族元素名称是,该元素对应的最低价氢化物分子的中心原子采取了杂化方式,分子的空间构型是 。
(2)富勒烯(C60)的结构如图,1molC60分子中σ键的数目为______ 。继C60后,科学家又合成了Si60、N60。请解释如下现象:熔点:Si60>N60>C60,而破坏分子所需要的能量: N60>C60>Si60,其原因是:。
(3)氟化氢水溶液中存在氢键有种。
(4)2011年诺贝尔化学奖授予了因发现准晶体材料的以色列科学家。某准晶体是锰与另一个短周期元素X形成的凝固态。已知:金属的电负性一般小于1.8。元素X与同周期相邻元素Y、Z的性质如下表:则X元素符号是,锰与X在准晶体中的结合力为。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某化学探究小组设计如下方案制备上述两种产品:
请回答下列问题:
(1)检验固体铁的氧化物中铁的化合价,应使用的试剂是(填标号)
| A.稀硫酸 | B.稀硝酸 | C.KSCN溶液 | D.酸性高锰酸钾溶液 |
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式:。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得高铁酸鉀。完成并配平下列化学方程式:
□Fe2O3+□KNO3+□KOH——□+□KNO2+□。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L—1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I—=2Fe2++I2、I2+2S2O32—=2I—+S4O62—。
①写出滴定选用的指示剂,滴定终点观察到的现象。
②溶液I中铁元素的总含量为g·L—1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会(填“偏高”、“偏低”、“不变”)。