多硫化钠Na2Sx(x≥2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰16,则x的值是
| A.5 | B.4 | C.3 | D.2 |
把下列四种碳酸氢钠溶液分别加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50 mL,此时碳酸氢钠和盐酸反应,其中反应开始时速率最大的是()
| A.10 ℃ 20 mL 3 mol·L-1的碳酸氢钠溶液 | B.20 ℃ 30 mL 2 mol·L-1的碳酸氢钠溶液 |
| C.20 ℃ 10 mL 4 mol·L-1的碳酸氢钠溶液 | D.10 ℃ 20 mL 2 mol·L-1的碳酸氢钠溶液 |
在2A+B ="===" 3C+4D反应中,表示该反应速率最快的是()
A.υ(A)="0.5" mol·(L·s)-1 B.υ(B)="0.3" mol·(L·min)-1
C.υ(C)="0.9" mol·(L·s)-1 D.υ(D)="1.0" mol·(L·s)-1
下列化学用语或模型正确的是()
A.氯化氢的电子式: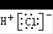  |
B.N2的结构式:N≡N |
C.硫离子结构示意图: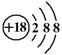 |
D.CH4分子的球棍模型: |
下列反应中,光照对反应几乎没有影响的是()
| A.H2与Cl2的反应 | B.氯气与甲烷的反应 |
| C.氧气与甲烷的反应 | D.浓HNO3的分解 |
正丁烷和异丁烷互为同分异构体的依据是()
| A.具有相似的化学性质 | B.具有相同的物理性质 |
| C.分子具有相同的空间结构 | D.分子式相同,但分子内碳原子的连接式不同 |