1.52 g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
| A.该合金中铜与镁的物质的量之比是2:1 |
| B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L |
| C.NO2和N2O4的混合气体中,NO2的体积分数是80% |
| D.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL |
25℃、101kPa时,1g甲醇完全燃烧生成CO2和液态H2O,同时放出22.68kJ热量。下列表示该反应的热化学方程式中正确的是()
| A.CH3OH(l)+3/2O2(g) = CO2(g) +2H2O(l) △H=-725.8 kJ·mol-1 |
| B.2 CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(l) △H="+1451.6" kJ·mol-1 |
| C.2 CH3OH+O2 = 2CO2+4H2O△H=-22.68 kJ·mol-1 |
| D.CH3OH(l)+3/2O2(g) = CO2(g)+2H2O(g)△H=-725.8 kJ·mol-1 |
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为()
A、 A﹥B﹥E﹥D B、 A﹥B﹥D﹥E
C、 D﹥E﹥A﹥B D、 D﹥A﹥B﹥E
电解稀H2SO4、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质分别是()
| A.H2和Cl2 | B.Cu和Cl2 | C.H2和O2 | D.Cu和O2 |
已知25℃、101 kPa下,石墨、金刚石燃烧的热化学方程式分别为C(石墨) + O2(g) ==== CO2(g) 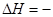 393.51 kJ/mol①;C(金刚石) + O2(g) ==== CO2(g)
393.51 kJ/mol①;C(金刚石) + O2(g) ==== CO2(g)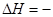 395.41 kJ/mol②,据此判断,下列说法正确的是()
395.41 kJ/mol②,据此判断,下列说法正确的是()
| A.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的低 |
| B.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高 |
| C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低 |
| D.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高 |
下列实验过程中,发生吸热反应的是()
| A.铝粉与氧化铁粉末反应 | B.乙醇燃烧 |
| C.碳酸钙受热分解 | D.碘单质升华 |