某校化学兴趣小组将用剩的过氧化氢溶液倒入放有生锈铁钉的废液缸中,发现产生了大量的气泡,经检验此气体为氧气.根据学过的知识初步判断,是生锈铁钉中的某种物质加快了过氧化氢的分解,那么究竟是哪种物质加快了过氧化氢的分解速率?请你参与他们的研究,分享和体验探究实验的快乐.
[猜想与假设]
甲同学:铁钉表面的氧化铁加快了H2O2的溶液分解.
乙同学:铁钉里的 加快了H2O2的溶液分解.
[设计方案和实验] 完成下列表格
| 实验方案 |
实验现象 |
结论 |
| 方案一:向盛有10mL 5% H2O2溶液的试管中 加入2g氧化铁粉末,将一根带火星的木条放 在试管口,观察现象. |
|
甲同学结论成立. |
| 方案二:向盛有10mL 5% H2O2溶液的试管中加入 粉末,将一根带火星的木条放在试管口,观察现象. |
|
乙同学结论 . (填“成立”或“不成立”) |
[讨论交流] 丙同学认为“方案一”只能说明Fe2O3加快了H2O2溶液的分解,并不能说Fe2O3就一定是催化剂.你是否支持丙同学的观点? ,如果要证明氧化铁是催化剂,就要设计一个实验来证明,这个实验的设计原理是 .
(提示:下面小题若答对将奖励4分,但化学总分不超过60分.)
[反思与评价] 丁同学仔细观察“方案二”中一直没有现象的试管,过了一段时间后发现试管中也产生了气体,丁同学对此现象进行深入思考和分析,得出可能的原因,你能想出其中的原因吗? 。
化学课上,同学们利用下列实验探究碱的化学性质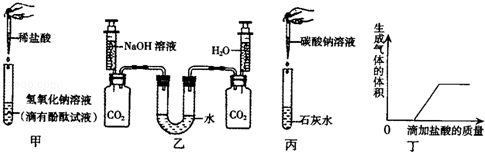
(1)甲实验中加入酚酞试液的目的是 ;
(2)乙实验利用控制变量法进行了对比,排除了水对实验的干扰.若观察到U形管左端的液面 (填“升高”或“降低”),则证明溶液中的氢氧化钠能与二氧化碳反应,其反应的化学方程式为 ;
(3)丙实验观察到的现象是 ;
(4)实验结束后,同学们将废液倒入同一只洁净废液缸中,发现废液浑浊并显红色,将废液进行过滤,对废液的成分做了进一步探究:
【实验探究】同学们取一定量过滤后的废液,向废液中逐滴加入稀盐酸,根据反应现象绘制了如丁图所示的示意图
【得出结论】分析图象数据,得出废液中(除酚酞外)一定含有的溶质是
碳酸钠和碳酸氢钠是初中化学教材中出现的两种常见的盐,同时也是日常生活中有重要应用的物质,下面是阳阳小组进行的研究性学习过程,请你参与并回答相关问题.
【资料获悉】
(1)相同条件下,Na2CO3溶液比NaHCO3溶液的碱性强;
(2)20℃时,Na2CO3、NaHCO3的溶解度分别为21.3g和9.6g;
(3)NaHCO3在270℃时能发生反应,而Na2CO3受热不易分解.
【探究过程】
实验一:阳阳同学想利用物理方法鉴别两种物质,请你参与或给予评价.
(1)可行,具体操作为 ,实验现象及结论为 .
(2)不可行,理由是 .
★(提示:上述情况选择一种进行作答)
实验二:亮亮同学用酸碱度的差异鉴别Na2CO3和NaHCO3.他应该选用 测定相同条件下两种溶液的PH,则pH较大的是 .
实验三:小明同学用加热的方法鉴别两种物质,具体操作为 ,NaHCO3发生分解反应的化学方程式为 .
实验四:小丽自己想出了一种新办法,取两种固体配制成溶液后,分别滴加过量澄清石灰水,结果都产生了白色沉淀,与小丽预想的只有碳酸钠溶液会产生白色沉淀的现象不符.小丽询问老师后得知,碳酸氢钠溶液也能与石灰水反应,请你将她的化学方程式补充完整:Ca(OH)2+NaHCO3═ +NaOH+H2O.
【交流总结】通过本组同学的探究,作为组长的阳阳同学根据已有的知识及实验情况,总结出了鉴别碳酸钠和碳酸氢钠的方法主要有:
①通过溶解度差异来鉴别 ②用无色酚酞试液进行鉴别 ③用加热的方法进行鉴别④加入稀盐酸进行鉴别 ⑤加入澄清石灰水进行鉴别⑥通过酸碱度差异来鉴别
你认为其中可行的是 (填序号).
【拓展延伸】
1.小苏打在日常生活中用于生产食品,主要起发泡作用.通过上述研究性学习过程,你们认为小苏打(NaHCO3)除用于食品工业外,在日常生活及实验室中还有哪些应用,试举一例: .
2.在以后的学习中,我们还可以从定量的角度设计实验鉴别这两种盐.
实验小组的同学研讨初中常见酸、碱、盐之间的反应关系时,做了如下实验,实验中的每一步均有明显现象,实验操作及部分现象如下图所示. 回答下列问题:
回答下列问题:
(1)A溶液一定呈 性(填“酸”或“中”或“碱”).
(2)气体D的化学式为 .
(3)步骤②的实验现象为 .
(4)E溶液中的溶质可能是 .
(5)B溶液的溶质由两种元素组成,④中产生气体的反应的化学方程式为 .
(6)实验后将盛有C固体烧杯中的上清液取出少量,继续加入E溶液,仍有C固体析出,已知A与E中的阳离子相同,则实验后所得溶液含有的溶质为 .
把一小包铁粉放入一定量的硫酸铜溶液中,使其充分反应后,过滤、洗涤、干燥,得到固体.请你对固体的成分进行探究.
(1)猜想:固体的成分可能是 .
(2)实验:请设计实验验证你的猜想.说明实验过程、现象和结论.
某学习小组在探究“酸的化学性质”时,做了如图所示的A、B两个实验.分别向氢氧化钠和碳酸钠溶液中加入一定质量的稀硫酸,反应结束后,把废液倒入同一个废液缸中,观察到废液缸中产生少量气泡.请回答下列问题: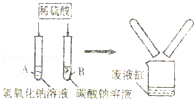
(1)试管A中的化学方程式是 ,在实验过程中并没有观察到该反应的明显现象,请你写出一种能观察到变化发生的方法
;
(2)通过分析废液缸中的现象,你认为B试管的废液中溶质成分是 (填化学式,下同);
(3)小组同学对废液缸中最终废液的成分进行探究,请你一起参与探究
【提出问题】最终废液中溶质是什么?
【查阅资料】硫酸钠溶液显中性
【假设猜想】猜想①:Na2SO4
猜想②:Na2SO4、Na2CO3
猜想③:
【实验探究】请你设计实验,确定哪个猜想是正确的.
| 实验步骤 |
实验结论 |
|
| 取少量废液于试管中 滴加紫色石蕊试液 |
|
猜想1正确 |
| |
猜想2正确 |
|
| |
猜想3正确 |