为研究黄铜(铜锌合金)的组成,某学习小组称取该样品10g,向其中逐滴加入9.8%的稀硫酸至刚好不再产生气体为止.生成的气体与所用硫酸溶液的质量关系如图所示,请计算: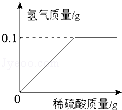
(1)10g样品中锌的质量是多少克?
(2)滴加的硫酸溶液质量是多少克?
已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4 Fe3O4+4CO↑+2CO2↑.
Fe3O4+4CO↑+2CO2↑.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).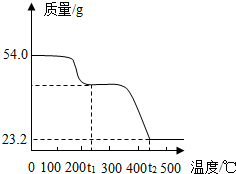
某干燥剂含氧化钙的质量分数是80%(杂质不吸水),理论上14g干燥剂能吸收水的质量是多少?有关反应的化学方程式为CaO+H2O═Ca(OH)2.
为减少二氧化碳等温室气体的排放,科学家采取“组合转化”技术,将CO2和H2在催化剂和加热条件下转化为一种重要的化工原料乙烯(C2H4)和H2O,反应化学方程式为2CO2+6H2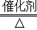 C2H4+4H2O.若要制得28g C2H4,需要CO2的质量是多少?
C2H4+4H2O.若要制得28g C2H4,需要CO2的质量是多少?
最近媒体报道油炸含有淀粉的食品会产生有毒的丙烯酰胺【化学式为C3H5NO】,食用后有害健康。试计算(要求写出计算过程,注意解题格式!):
(1)丙烯酰胺的相对分子质量是多少?
(2)丙烯酰胺中各元素的质量比m(C) :m(H) :m(N):m(O)是多少?
(3)丙烯酰胺中碳元素的质量分数是多少(计算结果精确至0.1%)?
小娟想测定Cu-Zn合金和Cu-Ag合金中铜的质量分数,实验室只提供了一瓶末标明溶质质量分数的稀盐酸和必要的仪器。
(1)你认为她能测出铜的质量分数的合金是合金。
(2)小娟取该合金的粉末32.5 g,与足量该盐酸充分反应后,经测定产生了0.4 g气体,请你帮助她计算出该合金中铜的质量分数。