常温下,下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c(NH4Cl)<c[(NH4)2SO4]<c[(NH4)2Fe(SO4)2]
B.已知25°C时Ksp(AgCl)=1.8×10-10,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH约为1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2->c(H2A)
实验室将9 g铝粉跟一定量的金属氧化物粉末混合形成铝热剂。发生铝热反应之后,所得固体中含金属单质为18 g,则该氧化物粉末可能是 ( )
| A.Fe2O3和MnO2 | B.MnO2和V2O5 |
| C.Cr2O3和V2O5 | D.Fe3O4和FeO |
某无色溶液加入铝可以生成H2,则在该溶液中一定能大量存在的离子组是
A.K+、Cu2+、N 、Cl- 、Cl- |
B.K+、Na+、Br-、Cl- |
C.K+、N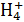 、HC 、HC 、Cl- 、Cl- |
D.Na+、Mg2+、Br-、S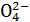 |
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体体积(V)与时间(t)关系如图。反应中镁和铝(注:反应速率为单位时间内生成气体的量)( )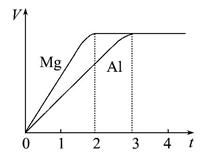
| A.物质的量之比为3∶2 | B.质量之比为3∶2 |
| C.摩尔质量之比为2∶3 | D.反应速率之比为2∶3 |
用坩埚钳夹住一小块刚用盐酸处理过的铝箔,在酒精灯上加热至熔化,发现熔化的铝箔不滴落。下列关于上述实验中有关问题的解释不正确的是 ( )
| A.铝在空气中能很快形成氧化膜 |
| B.铝箔失去金属光泽,氧化铝包裹着金属铝 |
| C.氧化铝的熔点比铝高 |
| D.氧化铝与盐酸不反应 |
下列关于铝元素的叙述正确的是 ( )
| A.铝是一种比较活泼的金属 |
| B.常温下铝不能与氧气反应 |
| C.氧化铝不能通过分解反应制得 |
| D.在化学反应中,铝容易得到电子,是氧化剂 |