将纯铜片和纯锌片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,电极反应:2H++2e→H2↑;乙中锌片是负极, 电极反应:Zn-2e→Zn2+ |
| C.两烧杯中的pH值均增大 |
| D.产生的气泡速率甲比乙慢 |
下列物质中属于电解质且能导电的是
| A.Cu | B.NaOH溶液 | C.熔融Na2CO3 | D.乙醇 |
近年来,光化学烟雾污染问题已引起人们的注意,下列哪种气体是造成光化学烟雾的主要因素
| A.NO2 | B.SO2 | C.CO2 | D.Cl2 |
在C(s)+CO2(g)  2CO(g)反应可使反应速率增大的措施是
2CO(g)反应可使反应速率增大的措施是
①增大压强 ②增加碳的量 ③通入CO2 ④恒压下充入N2 ⑤恒容下充入N2
| A.①③⑤ | B.②④ | C.①③ | D.③⑤ |
下列实验装置设计正确、且能达到目的的是
| A.实验Ⅰ:制取金属钠 |
| B.实验II:制取Fe(OH)2 |
| C.实验Ⅲ:制取少量的氢氧化铝 |
| D.实验Ⅳ:比较两种物质的热稳定性 |
人工光合作用能够借助太阳能,用CO2和H2O来制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是 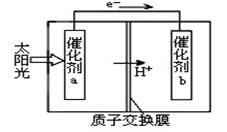
| A.该过程是将太阳能转化为化学能的过程 |
| B.催化剂a表面发生氧化反应,有O2产生 |
| C.催化剂a附近酸性减弱,催化剂b附近酸性增强 |
| D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH |