接触法制硫酸是先把SO2催化氧化成SO3,然后用浓硫酸吸收得到的SO3制取产品。某工厂生产硫酸时,进入接触室的原料气成分为SO27%、O2 11%、N2 82%(体积分数)。
(1)计算标准状况下10 m3原料气中的SO2物质的量______________mol。
(2)计算标准状况下1 0m3原料气的质量 千克。
(3)若SO2的转化率为99.2%,计算接触室导出的气体中SO3的体积分数 。
(4)若接触室导出的气体中含6.72%(体积分数)的SO3。把出口气体送进吸收塔,用
98.3%的硫酸吸收,可得到“发烟H2SO4”(H2SO4和SO3的混合物,其中含质量分数为20%的SO3)。计算吸收1000 m3出口气体(已折算为标准状况)所需要的98.3%的硫酸的质量 千克。
用于金属焊接的某种焊条,其药皮由大理石、水泥、硅、铁、铝等配制而成。试回答:
(1)30Si的原子的中子数为________。
(2)Al3+与Yn-的电子数相同,Y所在族的各元素的氢化物的水溶液均显酸性,则n=________。
(3)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(4)经处理后的熔渣36.0 g(仅含Fe2O3、Al2O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。(只写结果)
在4000C,101.3k Pa时,3 L某烃A在m L氧气中完全燃烧,燃烧后测得气体体积(m+6)
L(气体体积均在同温同压下测定)试回答下列问题:
(1)烃A的组成中应满足的条件;
(2)当m=27时,烃A可能的分子式(只要求写出三种可能的分子式)。三种可能的分子式是:,,;
(3)若烃A在常温常压下为气态物质时,m的取值范围。
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后的产物为CO2、CO和H2O(g)。产物经过浓硫酸后,浓硫酸的质量增加10.8 g;再通过灼热CuO充分反应后,固体质量减轻3.2 g;最后气体再通过碱石灰被完全吸收,碱石灰质量增加17.6 g。
(1)判断该有机物的化学式。
(2)若0.1 mol该有机物恰好与4.6 g金属钠完全反应,试确定该有机物的结构简式。(已知:一个碳上接两个羟基是不稳定的)
将6 mol H2和3 mol CO充入容积为0.5 L的密闭容器中,进行如下反应:
2 H2(g) + CO(g) 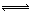 CH3OH(g),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,
CH3OH(g),6秒时体系达到平衡,此时容器内压强为开始时的0.6倍,
求:(1)H2的反应速率;(2)CO的转化率。
在25℃时,向100mL含氯化氢14.6g的盐酸里,放入5.6g铁粉(不考虑反应前后溶液体积的
变化),反应开始到2min末收集到H2 1.12L(标准状况),在此后,又经过4min,铁粉完全溶解。则:
(1)在前2min内用FeCl2 表示的平均反应速率是多少?
(2)在后4min内用HCl表示的 平均反应速率是多少?
(3)前2min与后4min相比,反应速率哪个较快?为什么?