已知溶液中:还原性: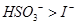 -氧化性
-氧化性 在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )
在含有3molNaHSO3的溶液中逐滴加入KIO3溶液,加入KIO3和析出I2的物质的量的关系如图所示,则下列说法错误的是( )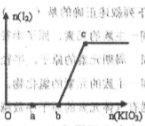
| A.a点时NaHSO3过量 |
| B.b点时还原产物为碘离子 |
| C.b点到c点,KIO3与NaHSO3反应生成单质碘 |
| D.加入的KIO3为0.4mol或1.12mol时,反应后溶液中碘离子均为0.4mol |
下列分子或离子在指定的分散系中能大量共存的一组是
| A.硝酸钠溶液:H+、Fe3+、SO42-、CH3COOH |
| B.烧碱溶液:K+、HSO3-、NO3-、NH3·H2O |
| C.空气:HCl、CO2、SO2、NO |
| D.氢氧化铁胶体:H+、K+、S2-、Br- |
下列离子方程式的书写与所得结论均合理的是
| 选项 |
离子方程式 |
结论 |
| A |
AgCl(s)+I﹣(aq)  AgI(s)+Cl﹣(aq) AgI(s)+Cl﹣(aq) |
溶解度:AgI>AgCl |
| B |
Fe2++H2O2+2H+===Fe3++2H2O |
氧化性:H2O2>Fe3+ |
| C |
CO32﹣+CO2+H2O===2HCO3﹣ |
稳定性:HCO3﹣>CO32﹣ |
| D |
NH3+H3O+===NH4++H2O |
得质子能力:NH3>H2O |
下列说法正确的是
| A.7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B.V L a mol·L﹣1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl﹣的数目大于3×6.02×1023 |
| C.标准状况下,22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 |
| D.工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的铜原子数为0.5×6.02×1023 |
用下列装置进行的相应实验能达到实验目的的是
| A.图1装置用于Cu和浓H2SO4反应制取少量的SO2气体 |
| B.图2装置用于分离水和溴苯的混合物 |
| C.图3装置用于制备并收集NO气体 |
| D.图4装置用于除去碳酸氢钠固体中的少量碳酸钠 |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增.X与Z位于同一族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
下列说法正确的是
| A.室温下,0.1 mol/L W的气态氢化物的水溶液的pH >1 |
| B.Z的最高价氧化物能与水反应生成相应的酸 |
| C.Y单质在一定条件下可以与氧化铁发生置换反应 |
| D.原子半径由小到大的顺序:X<Y<Z<W |