A~E是中学常见的5种化合物,A、B是氧化物,它们之间的转化关系如下图所示。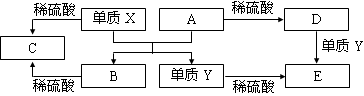
则下列说法正确的是
A.X与A反应的化学方程式是:Al2O3 + 2Fe Fe2O3 + 2Al
Fe2O3 + 2Al
B.检验D溶液中的金属阳离子的反应:Fe3++3SCN—=Fe(SCN)3↓
C.单质Y在一定条件下能与水发生置换反应
D.由于化合物B和C均既能与酸反应,又能与碱反应,所以均是两性化合物
可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法正确的是 ( )。
| A.以NaCl溶液或NaOH溶液为电解液时,正极反应都为O2+2H2O+4e- ===4OH- |
| B.以NaOH溶液为电解液时,负极反应为Al+3OH--3e-==="Al" (OH)3↓ |
| C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 |
| D.电池工作时,电子通过外电路从正极流向负极 |
水热法制备直径为1~100 nm的颗粒Y(化合物),反应原理为:
3Fe2+ + 2S2O32- + O2 + aOH-=" Y+" S4O62- + 2H2O,下列说法中不正确的是
| A.a=4 |
| B.将Y均匀分散到水中形成的体系具有丁达尔效应 |
| C.每有3 mol Fe2+ 参加反应,反应中转移的电子总数为5 mol |
| D.S2O32-是还原剂 |
能正确表示下列反应的离子方程式是
| A.Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B.等物质的量的MgCl2、Ba(OH)2和 HC1 溶液混合:Mg2++2OH-= Mg(OH)2↓ |
| C.将过量的SO2通入Ca(ClO)2溶液中: SO2+ClO-+H2O ="HClO+" HSO3- |
| D.将0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合: |
2Al3++3SO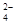 +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
下列各溶液中,一定能大量共存的是
| A.Fe3+、Na+、SO42-、H2O2 | B.C2H5OH、MnO4-、H+、K+ |
| C.Pb2+、K+、SO42-、Cl- | D.Na+、SO32-、CH3COO-、S2- |
甲、乙两个电解池均以Pt为电极且互相串联。甲池盛有AgNO3溶液,乙池盛有一定量的某盐溶液,通电一段时间后,测得甲池阴极质量增加2.16g,乙池电极析出0.24g金属,则乙池中溶质可能是
| A.CuSO4 | B.MgSO4 | C.Al(NO3)3 | D.Na2SO4 |