研究性学习小组对某硫酸亚铁晶体(FeSO4•xH2O)热分解研究,该小组同学称取ag硫酸亚铁晶体样品按图1高温加热,使其完全分解,对所得产物进行探究,并通过称量装置B质量测出x的值。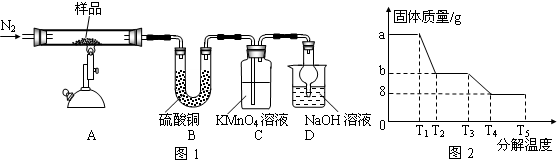
(1)装置B中硫酸铜粉末变蓝,质量增加12.6g,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有 。
(2)实验中要持续通入氮气,否则测出的x会 (填“偏大”、“偏小”或“不变”)。
(3)硫酸亚铁晶体完全分解后装置A中还残留红棕色固体Fe2O3。
(4)从理论上分析得出硫酸亚铁分解还生成另一物质SO3,写出FeSO4分解的化学方程式 。
(5)装置D球形干燥管的作用 。
(6)某研究所利用SDTQ600热分析仪对硫酸亚铁晶体(FeSO4•xH2O)进行热分解,获得相关数据,绘制成固体质量——分解温度的关系图如图2,根据图2中有关数据,可计算出FeSO4•xH2O中的x
=_________________________。
某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯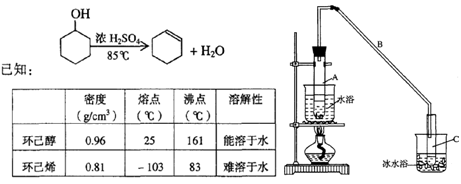
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B作用是____________。
②试管C置于冰水浴中的目的是_______________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、 分层,环己烯在_________层(填上或下),分液后用_________ (填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按右图装置蒸馏,冷却水从_________口进入。蒸馏时要加入生石灰,目的是__________________。
③收集产品时,控制的温度应在_________左右,
实验制得的环己烯精品质量低于理论产量,可能的原因是()
a.蒸馏时从70℃开始收集产品
b.环己醇实际用量多了
c.制备粗品时环己醇随产品一起蒸出
(3)以下区分环己烯精品和粗品的方法,合理的是_________。
a.用酸性高锰酸钾溶液 b.用金属钠 c.测定沸点
I.课本中介绍了乙醇氧化的实验:把一端弯成螺旋状的铜丝放在酒精灯外焰加热,待铜丝表面变黑后立即把它插入盛有约2 mL乙醇的试管里,反复操作几次。注意闻生成物的气味,并观察铜丝表面的变化。
(1)实验室可用化学方法替代“闻生成物的气味”,写出该化学方法的化学反应方程式__________________________________________________。
(2)某同学在探究“闻生成物的气味”的替代方法时,偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。请你设计一个简单的实验,探究哪一种猜想正确?
Ⅱ.某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约lmin后鼓入空气。请填写下列空白: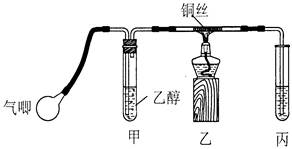
(1)乙醇发生催化氧化的化学反应方程式为________________________________________。
(2)实验时,常常将甲装置浸在70℃~80℃的水浴中,目的是____________________;由于装置设计上的缺陷,实验进行时可能会______________________________。
(3)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。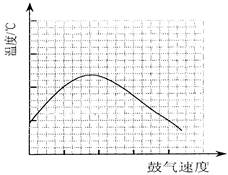
试解释出现图中现象的原因:______________________________;你认为该实验中“鼓气速度”这一变量可用______________________________来计量。
用50mL 0.55mol/L NaOH溶液和50mL 0.25mol/L H2SO4溶液来做中和热测定的实验,测得溶液在反应前后的温度变化为t1℃~t2℃(t2>t1),混合后溶液的比热容为c = 4.18J/(g·℃),溶液的密度都近似为1g/mL,中和热△H=____________________(填表达式,不用化简)
若将H2SO4溶液换成相同物质的量浓度的CH3COOH溶液,测得的△H______填(“偏大”、“偏小”或“相同”)
若将稀硫酸换成浓硫酸来做该实验,测得的△H___________(填“偏大”、“偏小”或“相同”)
实验室进行某项实验并检验反应产物的装置如下图:
将足量浓氨水从分液漏斗中加入烧瓶中后,如图进行实验,实验现象记录如下: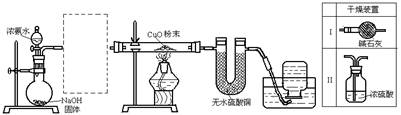
①黑色氧化铜粉末变为光亮红色;②无水硫酸铜粉末变蓝色③集气瓶中收集到一种无色气体。
请回答下 列问题:
列问题:






(1)虚线框内是否应添加必要的干燥装置? _________ (填“是”或“否”)。若需要,应选择的干燥装置是___________(填编号,若不需要,该空可不填)。
(2)在实验中通过现象可以判断反应进行,现象是:___________________________。
(3)最终集气瓶中收集到的气体是_____;CuO粉末处发生化学反应方程式为___________。
(4)在U形管和水槽间是否要加入右边的装置________(填“是”或“否”)。若需要,说明理由___________ (填编号,若不需要
(填编号,若不需要 ,该空可不填)。
,该空可不填)。
(10分)有一瓶浅绿色的硫酸亚铁晶体,由于保存不善,导致它在空气中敞口放置了较长的时间,因此该晶体可能被氧化。试用实验证明它是未被氧化或部分被氧化还是全部被氧化,并完成实验报告。
(1)实验目的: 。
(2)实验步骤:
①取少量该晶体溶于水,加酸酸化;
②将溶液分成两份,并置于洁净的试管中,向其中一份溶液中滴加几滴KSCN溶液;
③向另一份溶液中滴加少量的KMnO4溶液。
(2)第①步用酸酸化可以用下列的酸是
| A.稀硝酸 | B.盐酸 | C.浓硫酸 | D.稀硫酸 |
(3)结论:
① ,则说明部分被氧化。
② ,则说明全部被氧化。
③写出硫酸亚铁溶液在酸性条件被氧化的离子反应方程式 。