下列叙述Ⅰ和叙述Ⅱ均正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
碳酸钠能与盐酸反应 |
碳酸钠可用于在医疗上是治疗胃酸过多的一种药剂 |
| B |
钠的金属性强于铜 |
金属钠可置换硫酸铜溶液中的铜 |
| C |
氧化镁的熔点高 |
氧化镁可以用耐火材料 |
| D |
硬铝是合金材料 |
硬铝在空气中生成致密氧化膜 |
【原创】在溶液中能大量共存,通入氯化氢后有沉淀生成的离子组是
| A.Al3+、NH4+、NO3-、SO42- | B.Ba2+、K+、OH-、CO32- |
| C.K+、Na+、Br-、SiO32— | D.K+、Fe2+、NO3-、Cl- |
【原创】生活中处处有化学。下列说法正确的是
| A.油脂、淀粉、纤维素以及蛋白质均可作为人类的营养物质 |
| B.乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
| C.乙醇、乙酸和甲醛广泛应用于食品加工 |
| D.将氯气通入澄清石灰水中制漂白粉 |
某反应:2A(g) 3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是
3B(g)的各物质的浓度隨时间变化如图所示,则有关反应速率表示正确的是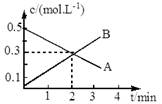
A.v(A)=0.1mol/(L.min)
B.v(B)=0.2mol/(L.min)
C.v(A)=" v(B)" ="0.5" mol/(L.min)
D.v(A)=" v(B)" ="0.3" mol/(L.min)
铜锌原电池装置(见图),下列分析正确的是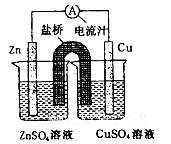
| A.一段时间后两烧杯中c(Zn2+)、c(Cu2+)均减小 |
| B.原电池工作时,Cu电极流出电子,发生氧化反应 |
| C.原电池工作时的总反应为Zn+Cu2+=Zn2++Cu |
| D.盐桥中装有含氯化钾的琼脂,其作用是传递电子 |