对于可逆反应:
 ,下列研究目的和示意图相符的是
,下列研究目的和示意图相符的是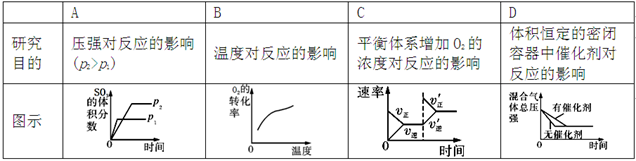
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是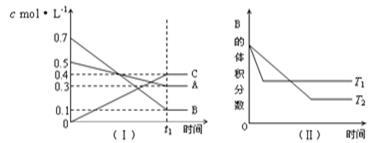
A.在t1min时,3V正(B)=2V逆(C)
B.(t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向正反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A、0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
在某一容积为2L的密闭容器内,加入0.2mol的CO和0.2mol的H2O,在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g) CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
CO2(g)+H2(g);ΔH=a kJ/mol(a>0),反应达到平衡后,测得c(CO):c(CO2)=3:2。下列说法正确的是
| A.反应放出的热量为0.2a kJ |
| B.平衡时H2O的转化率为40% |
| C.若升高温度,v(正)加快,v(逆)减慢,平衡正向移动 |
| D.若将容器的体积压缩为1L,有利于该反应平衡正向移动 |
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:
2X(g)+Y(g) Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是
| A.以X浓度变化表示的反应速率为0.001 mol/(L·s) |
B.将容器体积变为20 L,Z的平衡浓度变为原来的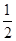 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的ΔH>0 |
下列离子方程式不正确的是
A.纯碱溶液中滴加酚酞溶液显红色:CO32-+H2O  HCO3-+OH- HCO3-+OH- |
| B.烧碱溶液与小苏打溶液混合:HCO3-+OH-=CO32-+H2O |
| C.硫代硫酸钠溶液与稀硫酸混合:3S2O32-+6H+=4S↓+3H2O+2SO3 |
| D.氢氧化铁溶于氢碘酸:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
部分弱电解质的电离平衡常数如下表,以下选项错误的是
| 化学式 |
NH3·H2O |
CH3COOH |
HCN |
H2CO3 |
| Ki(25℃) |
1.8×l0—5 |
1.8×l0—5 |
4.9×l0—10 |
Ki1= 4.3×l0—7 Ki2= 5.6×l0—11 |
A.等物质的量浓度的NaHCO3和NaCN溶液,前者溶液中水的电离程度大
B.0.1 mol/L CH3COONa 溶液显碱性,0.1 mol/L CH3COONH4溶液显中性
C.CN-+H2O+CO2→HCN+ HCO3-
D.中和等体积、等pH的CH3COOH和HCN消耗NaOH的量前者小于后者