探究燃烧条件的实验装置如图所示.观察到实验现象如图: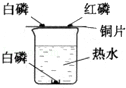
A.烧杯中白磷不燃烧;
B.铜片上白磷燃烧,产生大量白烟;
C.铜片上红磷不燃烧。
(1)由现象A和B得到燃烧的条件是 ;
(2)实验中发生反应的化学方程式为 ;
(3)实验中使用铜片,是利用了铜的 性。
美国两位科学家利用碘元素,借助放射学进行了“G蛋白偶联受体” 研究,揭开了“细胞如何感知周围环境”之谜,获得了2012年诺贝尔化学奖。下图是碘元素在元素周期表中的部分信息及碘原子的结构示意图。请回答: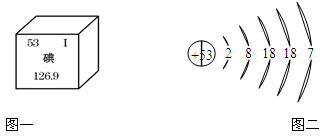
(1)由图一可知碘元素的相对原子质量是;
(2)下列与碘元素化学性质相似的是(填字母)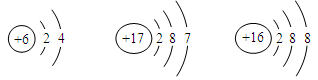
A B C
下图表示一瓶氯化锌溶液,请用正确的化学用语填空:
(1)写出右图标签的横线上氯化锌的化学式。
(2)写出氯化锌溶液中大量存在的阴离子的符号;
(3)标出溶剂水中氢元素的化合价;
自来水生产中通常用适量的氯气杀菌消毒,以食盐(NaCl)为原料制取氯气的流程如下图所示,根据题意填写下列空白:
(1)上述过程中的涉及的物质属于碱的是__________(写化学式)。
(2)过程②发生反应的化学方程式为
2NaCl+2X通电2NaOH+H2↑+Cl2↑,其中X的化学式为_________,
在反应前后Cl元素的化合价分别为_______________。
(3)氯化钠和氢氧化钠溶解度曲线如图所示,温度为t2时,过程①要将36g氯化钠配制成饱和溶液,需要水的质量为_____g;过程③要得到氢氧化钠固体所采取的结晶方法为 ____________。
材料一:2014年3月,某市酒吧发生一起特大火灾。该事故的起因是几个年轻人在酒吧内燃放烟花,引燃聚氨酯泡沫塑料天花板。聚氨酯泡沫塑料燃烧产生大量有毒烟气,造成人员中毒伤亡。
材料二:氢氧化镁是一种新型的阻燃剂。当温度达到380℃时,氢氧化镁开始分解出水蒸气,同时生成耐高温的氧化镁固体。利用氢氧化镁这一性质,将它添加到塑料等易燃性材料中能起阻燃作用。
(1)聚氨酯泡沫塑料属于___________ (填“有机”或“无机”)材料。
(2)燃着的烟花在引发这场火灾中所起的作用是___________ (填标号)。
A.提供氧气 B.使可燃物的温度达到着火点 C.提供可燃物
(3)根据灭火原理初步分析氢氧化镁能作阻燃剂的原因是______________________(答1点)。氢氧化镁受热分解的化学方程式为______________________。
当今,染发已经成为一种时尚,年轻人可以随自己的心情和喜好改变头发的颜色,给人眼前一亮的感觉。但是它在给予我们美丽的同时,会对我们的健康造成伤害,染发剂中的染料具有一定的毒性、刺激性和过敏性。例如,染发剂中普遍含有对苯二胺(其化学式为C6H8N2)会使易过敏的人引起发痒、水肿、气喘、胃炎和贫血等症状,另外它还具有致癌作用。因此,科学界告诫我们:慎用染发剂,少染发为好。
⑴ 对苯二胺属于(选填“有机物”、“氧化物”、“酸”、“碱”、“盐”之一)。
⑵ 一个对苯二胺分子中含有个原子。
⑶在对苯二胺中,所含元素的质量分数最大的元素是。
⑷ 下列说法正确的是(填序号)
① 使用含有对苯二胺的染发剂对人体无害
② 青少年可以经常染发,从而使心情愉悦
③ 在染发之前,最好进行皮肤测试,看看染发剂是否对自己有过敏性反应