关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3- 对人类健康会产生危害,为了降低饮用水中NO3-的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O。请回答下列问题:
①上述反应中的氧化剂为 。
②上述反应中若生成标况下3.36LN2,则转移的电子数为 。
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上制取氯气的化学反应方程式为 。
②漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,反应的离子方程式为 。
下列各溶液中,微粒物质的量浓度关系正确的是( )
A.0.1 mol·L-1Na2CO3溶液中c(OH-)=c(HC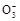 )+c(H+)>c(C )+c(H+)>c(C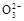 ) ) |
B.0.1 mol·L-1(NH4)2SO4溶液中:c(S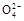 )>c(N )>c(N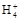 )>c(H+)>c(OH-) )>c(H+)>c(OH-) |
C.0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(OH-)>c(HC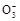 )>c(H+) )>c(H+) |
| D.0.1 mol·L-1Na2S溶液中:c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) |
下列叙述正确的是( )
A.浓度均为0.1 mol·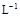 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中: 的CH3COOH和CH3COONa溶液等体积混合所得的溶液中:c(CH3COOH)+c(CH3COO-)="0.2" mol· 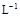 |
B.0.1 mol·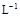 NaHCO3溶液中:c(Na+)=c(HC NaHCO3溶液中:c(Na+)=c(HC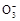 )+c(H2CO3)+2c(C )+c(H2CO3)+2c(C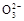 ) ) |
C.0.2 mol·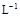 HCl溶液与等体积的0.1 mol· HCl溶液与等体积的0.1 mol·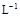 NaOH溶液混合后,溶液的pH=1 NaOH溶液混合后,溶液的pH=1 |
D.0.1 mol·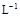 氨水中滴入0.1 mol· 氨水中滴入0.1 mol·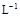 盐酸至溶液呈中性时,混合溶液中:c(N 盐酸至溶液呈中性时,混合溶液中:c(N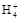 )=c(Cl-) )=c(Cl-) |
25 ℃时,浓度为0.2 mol/L的NaHCO3溶液中,下列判断不正确的是( )
A.存在电离平衡HC  H++C H++C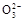 |
B.存在水解平衡HC +H2O +H2O H2CO3+OH- H2CO3+OH- |
| C.将溶液加热蒸干、灼烧得Na2O2固体 |
D.加入NaOH固体,恢复到原温度,c(OH-)、c(C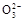 )均增大 )均增大 |
蒸干FeCl3水溶液后再加强热,得到的固体物质主要是( )
| A.FeCl3 | B.FeCl3·6H2O | C.Fe(OH)3 | D.Fe2O3 |
下列应用与盐类的水解无关的是( )
| A.纯碱溶液可去除油污 |
| B.NaCl可用作防腐剂和调味剂 |
| C.TiCl4溶于大量水加热制备TiO2 |
| D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |