化学在能源开发与利用中起着十分关键的作用。氢气是一种新型的绿色能源,又是一种重要的化工原料。
I.氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行如图实验(图中所用电极均为惰性电极):
(1)对于氢氧燃料电池中,下列表达不正确的是________
| A.a电极是负极,OH-移向正极 |
| B.b电极的电极反应为:O2+2H2O+4e-=4OH- |
C.电池总反应式为:2H2+O2 2H2O 2H2O |
| D.电解质溶液的pH保持不变 |
E.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
(2)上图装置中盛有100mL、0.1mol·L—1AgNO3溶液,当氢氧燃料电池中消耗氢气112mL(标准状况下)时,则此时上图装置中溶液的pH=________(溶液体积变化忽略不计)
II.氢气是合成氨的重要原料。工业上合成氨的反应是:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
反应进行到2小时时放出的热量为________
0~1小时内N2的平均反应速率________mol·L-1·h-1;
③此条件下该反应的化学平衡常数K=________(保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
(1)一定温度下,在恒容密闭容器中N2O5可发生下 列反应:2N2O5(g)
列反应:2N2O5(g)  4NO2(g)+O2(g) ;⊿H>0
4NO2(g)+O2(g) ;⊿H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将(填“增大”、
“减小”或“不变”)。
②下表为反应在T1温度下的部分实验数据:
| t/s |
0 |
500 |
10 00 00 |
| c(N2O5)/mol·L—1 |
5.00 |
3.52 |
2.48 |
则500s内N2O5的分解速率为。
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol/L,则T2T1。(填“>”、“<” 或 “ =”)
(2)如图所示装置可用于制备N2O5,则N2O5在电解池的区 (填“阳极”或“阴极”)生成,其电极反应式为。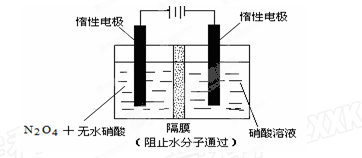
铅蓄电池是典型 的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO2-4 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原)
①放电时:正极的电极反应式是______________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
②在完全放电耗尽PbO2和Pb时,若按题图连接,电解一段时间后,则在A电极上生成__________、B电极上生成________,此时铅蓄电池的正负极的极性将___。(填“不变”或“对换”)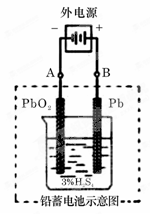
某地区用含较多Ca2+,Mg2+的天然水按照下列步骤制取蒸馏水。请回答下列问题。步骤:天然水→①沉降→②过滤→③曝气→④离子交换→⑤消毒→纯净水
(1)该地区的天然水属于(“硬水”或“软水”)。
(2)在第①步中需要加入凝聚剂,常用的凝聚剂可以是。
(3)经过第④步离子交换后要经过杀菌消毒才能直接饮用。常用的消毒方式有。
(4)若采用药剂法软化天然水,可以向其中加入碳酸钠,发生反应的离子反应方程式是
,如果是暂时硬度,可用加热的方法除去,请写出发生的化学反应方程式 (写出一个即可)。
(写出一个即可)。
将锌片和铜片用导线相连后一同插入稀硫酸中,导线上便有电流通过。
(1)锌片为______(填“正极”或“负极”),电极反应是。
(2)铜片为__________(填“正极”或“负极”),发生反应(填“ 氧化”或“还原”)。
氧化”或“还原”)。
(3)该原电池工作时,溶液中的SO42-向极移动,铜极上的现象是。
 下边是日照2
下边是日照2 010年9月11日的空气质量日报
010年9月11日的空气质量日报
| 污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
||
| 二氧化硫 |
二氧化氮 |
可吸入颗粒物 |
|||
| 12 |
33 |
66 |
2 |
良 |
(1)首要污染物是
(2)污染指数是
(3)能引起光化学烟雾的是(从表中选)
(4)能引起酸雨的是(从表中选)