以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
请回答下列问题:
(1)流程图中操作①、②、③分别指的是①_________、②__________、③________。
操作④、⑤用到的主要仪器是:④__________、⑤__________(每空填1-2个仪器)。
(2)判断溶液中SO42-离子已沉淀完全的方法是_________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,准确称取一定量的矿石试样,试样经溶解、预处理后,
| A.用带有刻度的烧杯配制成100 mL试样溶液。 | B.用量筒量取25.00 mL待测溶液, | C.并置于锥形瓶中。 | D.用蒸馏水洗涤滴定管后装入KMnO4标准溶液,用该标准溶液滴定待测试样,(E)当溶液变成淡紫红色时,停止滴定,如30秒内不褪色,(F)读取并计算滴定管中消耗的KMnO4标准溶液体积,计算试样中的Fe元素含量。请指出该实验过程中错误操作步骤的编号________________________。 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是_____________________________________________。
(5)称取矿石试样1.60 g, 按方法Ⅰ分析,称得BaSO4的质量为4.66 g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是___________。
孔雀石主 要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下:
要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。实验室以孔雀石为原料制备CuSO4·5H2O及纳米材料G,步骤如下: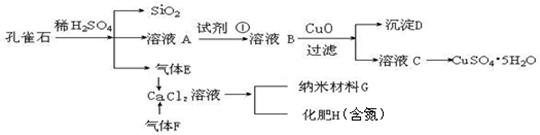
请回答下列问题:
(1)溶液A的金属离子有Cu2+、Fe2+、Fe3+。从下列所给试剂中选择:实验步骤中试剂①最佳为 (填代号),检验溶液A中Fe3+的最佳试剂为 (填代号)。
a.KMnO4/H+ b.Cl2 c.H2O2 d.KSCN
沉淀D中除了过量的CuO外,还存在另一种固体,其化学式为 ,
加入CuO作用是 。
(2)由溶液C获得CuSO4·5H2O,需要经过操作。除烧杯、漏斗外,过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 。
(3)制备纳米材料G时,应向CaCl2溶液中选通入(或先加入) (填化学式)。
写出该反应的化学方程式 。
(4)欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4标准溶液应使用 。取A溶液稀释一定倍数后,用KMnO4标准溶液滴定,终点现象为 。
为测定足量铜与适量一定浓度的浓硝酸反应生成的NO气体和NO2气体的物质的量之比(用m表示),请从下图中选用适当的实验装置,设计一个合理而简单的实验,用于测定m的值。其中E装置由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0mL~50mL),供量气用,乙管可上下移动,用来调节液面高低。




A B C D E
回答下列问题:
(1)实验中气体(NO和NO2)发生装置应选择(填装置序号)。
(2)要测定m值,需要将C中的溶液进行中和滴定,由于浓硝酸具有强 氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
氧化性,能把酸碱指示剂氧化褪色而影响实验。因此,中和滴定前必须进行的操作是。
(3)装置的连接顺序是(填各装置接口的编号,连结胶管及夹持装置均省略)。
(4)连接好装置,检查气密性后,应进行两步必要的操作:
第一,打开b,向E装置右管中加适量水;
第二。
(5)实验前甲、乙两管液面在同一水平面上,最后读数时乙管的液面高于甲管的液面。此时应进行的操作是。
(6)实验后若量气管中气体的体积(换算成标准状况下)为V(L),C中硝酸的物质的量为 n mol,则用含n和V的式子表示m=。
(10分)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图: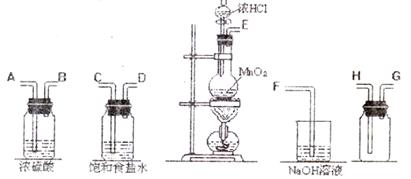
(1)连接上述仪器的正确顺序是(填各接口处的字母):E接,接,接H,G接F。
(2)在装置中;①饱和食盐水起的作用是;
②浓硫酸起的作用是。
(3)化学实验中检验是否有Cl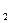 产生常用湿润的淀粉—KI试纸。如果有Cl
产生常用湿润的淀粉—KI试纸。如果有Cl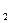 产生,可观察到的现象是,写出反应方程式。
产生,可观察到的现象是,写出反应方程式。
(4)写出下列化学反应的离子方程式
①气体发生装置中进行的反应:;
②尾气吸收装置中进行的反应:。
下图是实验室里的一种常用装置,利用它可进行若干实验。
(1)若在瓶中盛满水,用它作量气装置,则气体应从端通入,用它可以测量下列哪些气体的体积(填编号)。
①H2 ②O2 ③NH3 ④CO2
(2)若用它作干燥装置来干燥CO2气体,则气体应从端通入,瓶中可选用下列哪些干燥剂 (填编号)。
(填编号)。
①碱石灰 ②浓硫酸 ③生石灰
(3)若用它作气体的收集装置,用排空气法收集气体,当从A端通入气体时,可收集下列哪些气体(填编号)。
①CO2 ②H2 ③SO2④NH3
某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:________________________________,D:____________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为:
B:________________________________,D:____________________________。
(2)实验中NaOH溶液的作用是:______________________________________ 。
写出Cl2通入NaOH溶液中的化学方程式_______________________________。