某化学小组用下图所示装置验证卤素单质氧化性的相对强弱。下列说法不正确的是
A.E处棉花球变成黄色,说明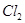 的氧化性比 的氧化性比 强 强 |
B.F处棉花球变成蓝色,说明 的氧化性比 的氧化性比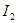 强 强 |
C.E处发生反应的离子方程式为: |
D.G装置中 溶液与 溶液与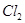 反应的离子方程式为: 反应的离子方程式为: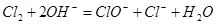 |
某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示。下列有关评价正确的是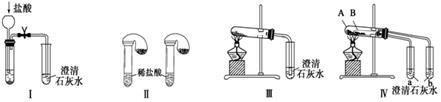
| A.根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体 |
| B.在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体 |
| C.与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 |
| D.若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠 |
溶液中能大量共存,加入OHˉ有沉淀析出,加入H+能放出气体的是
| A.Na+、HCO3-、Ca2+、Cl- | B.Ba2+、K+、OH-、NO3- |
| C.H+、Fe3+、NH4+、SO42- | D.Mg2+、Na+、Cl-、CO32- |
一定条件下,当溶液中XO4- 与H2O2分子个数比恰好为2︰5时,溶液中XO4- 离子被还原为较低价态,则X元素的化合价变为
| A.+2 | B.+3 | C.+4 | D.+5 |
对于某些离子的检验及结论一定正确的是
| A.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液一定有SO42- |
| B.验证烧碱溶液中是否含有Cl﹣,先加稀硝酸除去OH﹣,再加入AgNO3溶液,有白色沉淀,证明有Cl﹣ |
| C.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,原溶液中一定有CO32- |
| D.加入氯水后,滴加KSCN溶液,溶液变红,原溶液中一定有Fe2+ |
同温同压下,x g的甲气体和y g的乙气体占有相同的体积,根据阿伏加德罗定律判断,下列叙述错误的是
| A.x∶y等于甲与乙的相对分子质量之比 |
| B.y∶x等于同温同体积下等质量的甲与乙的压强之比 |
| C.x∶y等于同温同压下甲与乙的密度之比 |
| D.x∶y等于等质量的甲与乙的分子个数之比 |