下列离子方程式改写成化学方程式正确的是( )
| A.Mg2++2OH-=Mg(OH)2↓ MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓ |
| B.Fe+Cu2+=Fe2++Cu Fe+Cu(OH)2=Fe(OH)2+Cu |
| C.Ag++Cl-=AgCl↓ AgNO3+HCl=AgCl↓+HNO3 |
| D.CO2+2OH-=CO32-+H2O CO2+Cu(OH)2=CuCO3↓+H2O |
下列操作能达到实验目的的是
| A.分离水和CCl4并回收CCI4 |
| B.定容 |
| C.比较两种盐的热稳定性 |
| D.制取氢氧化亚铁 |
根据下列标准,分类合理的是
| A.根据物质的组成元素是否单一,将纯净物分为单质和化合物 |
| B.根据电解质溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C.根据分散系是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.根据反应中的能量变化,将化学反应分为氧化还原反应、非氧化还原反应 |
在生活、生产中,下列行为安全合理的是
| A.向燃着的酒精炉中添加酒精 |
| B.在含有大量铝粉尘的车间使用明火 |
| C.金属钠着火时用水灭火 |
| D.氨气泄漏时用湿毛巾捂住口鼻逃生 |
根据下图海水综合利用的工业流程图,判断下列说法正确的是
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
| A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸 |
| B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2 |
| C.从能量角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程 |
| D.从第③步到第⑤步的目的是为了浓缩富集溴 |
电导率可用于衡量电解质溶液导电能力的大小。室温下,用0.100 mol·L-1 NH3·H2O滴定10 mL浓度均为0.100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。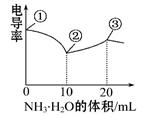
下列说法正确的是
| A.①溶液中c(H+)为0.200 mol·L-1 |
| B.溶液温度高低为①>③>② |
| C.③点溶液中有c(Cl—)>c(CH3COO—) |
| D.③点后因离子数目减少使电导率略降低 |