一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是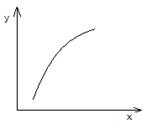
| 选项 |
x |
y |
| A |
温度 |
容器内混合气体的密度 |
| B |
CO的物质的量 |
CO2与CO的物质的量之比 |
| C |
SO2的浓度 |
平衡常数K |
| D |
MgSO4的质量(忽略体积) |
CO的转化率 |
以下措施能使层析实验达到较好分离效果的是( )
| A.配制时试样溶液的浓度较大,点样时试样点斑较小 |
| B.配制时试样溶液的浓度较大,点样时试样点斑较大 |
| C.配制时试样溶液的浓度较小,点样时试样点斑较小 |
| D.配制时试样溶液的浓度较小,点样时试样点斑较大 |
油墨是由多种色素按一定比例混合而成,某同学欲用纸层析的方法将其主要色素分离开来,可用作展开剂的物质是( )
| A.盐酸 | B.酒精 |
| C.NaOH溶液 | D.丙酮+盐酸 |
从菠菜的叶绿体中提取色素时,没有涉及的基本操作为( )
| A.过滤 | B.分液 |
| C.萃取 | D.蒸馏 |
根据“相似相溶”原理,已知胡萝卜素易溶于石油醚,则可推出其易溶于( )
| A.水 | B.苯 |
| C.酒精 | D.甘油 |
如图所示的分离物质的方法是(双选)( )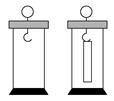
| A.纸色谱法 | B.萃取法 |
| C.吸附法 | D.纸层析法 |