在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g) nY(g) ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是
nY(g) ΔH=QkJ/mol。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示,下列说法正确的是
| 容器体积/L c(Y)/mol/L 温度/℃ |
1 |
2 |
3 |
| 100 |
1.00 |
0.75 |
0.53 |
| 200 |
1.20 |
0.90 |
0.63 |
| 300 |
1.30 |
1.00 |
0.70 |
A.m>n B.温度不变,压强增大,Y的质量分数减少
C.Q<0 D.体积不变,温度升高,平衡向逆反应方向移动
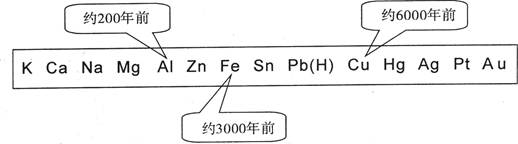
| A.金属的化合价高低 | B.金属的活动性大小 |
| C.金属的导电性强弱 | D.金属在地壳中的含量多少 |
| A.温室效应——二氧化碳 | B.光化学污染——二氧化氮 |
| C.酸雨——二氧化碳 | D.臭氧层破坏——氟氯烃 |

 将一定量A、B装入容积为1L的恒温密闭容器中,发生反应:2A(g)+bB(g)
将一定量A、B装入容积为1L的恒温密闭容器中,发生反应:2A(g)+bB(g) cC(g),1min时达到平衡,C的浓度为xmol·L—1。若保持温度不变,将密闭容器的容积压缩为原来的
cC(g),1min时达到平衡,C的浓度为xmol·L—1。若保持温度不变,将密闭容器的容积压缩为原来的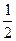 ,重新达到平衡后,C的浓度为2.5x mol·L—1,下列说法正确的是()
,重新达到平衡后,C的浓度为2.5x mol·L—1,下列说法正确的是()
A.化学计量数的关系:b<c
B.容器的容积减小后,该反应的逆反应速率减小
C.原容器中用B的浓度变化表示该反应在1min内的速率为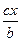 mol·L—1·min—1
mol·L—1·min—1
D.若保持温度和容器的容积不变,充入氦气(不参与反应),平衡不发生移动
在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是()
① K+、Cl-、NO3-、S2-② K+、Fe2+、I-、SO42-③ Na+、Cl-、NO3-、SO42-
④ Na+、Ca2+、Cl-、HCO3-⑤ K+、Ba2+、Cl-、NO3-
| A.①③ | B.③⑤ | C.③④ | D.②⑤ |
某化学科研小组研究在其他条件不变时,改变某一条
件对A2(g)+3B2(g)  2AB3(g)化学平衡状态的影响,
2AB3(g)化学平衡状态的影响,
得到如下图所示的变化规律(图中T表示温度,n表
示物质的量),根据如图可得出的判断结论正确的是
()
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1:3