PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g) PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
| |
PCl3(g) |
Cl2(g) |
PCl5(g) |
| 初始浓度(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度(mol/L) |
c1 |
c2 |
0.4 |
A.10 min内,v(Cl2) =" 0.04" mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的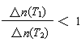
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
氰酸铵(NH4CNO)与尿素[CO(NH2)2]
| A.互为同系物 | B.互为同分异构体 |
| C.都是共价化合物 | D.都是有机化合物 |
下列说法正确的是
A.H、D、T表示三种氢原子
B.卤族元素最高化合价均为正7价,最低化合价均为负1价
C.金属元素的原子最外层电子数,都少于4个
D.目前人们已发现了5000多种核素,说明发现了5000多种元素
下列化学用语对应正确的是
A.Cl-离子的结构示意图: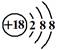 |
B.白磷分子的比例模型: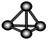 |
| C.H2O2的结构式:H-O-O-H |
D.CCl4的电子式: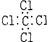 |
绿色能源是指使用不会对环境造成污染的能源。下列属于绿色能源的是
①太阳能 ②风能 ③潮汐能 ④ 煤 ⑤天然气 ⑥石油
| A.①②③ | B.③④ | C.④ | D.①②⑥ |
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生反应:2A(g)+B(g)  2C(g),若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:
2C(g),若经2s后测得C的浓度为0.6mol/L,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6mol/(L·s)
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol/L。其中正确的是
| A.①③ | B.②③ | C.①④ | D.②④ |