现有0.1mol·L-1的Na2SO4和0.1mol·L-1的H2SO4混合溶液100mL,向其中逐滴加入0.2mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略溶液体积变化)
⑴当加入50mLBa(OH)2溶液时,发生反应的总离子方程式为 ,所得溶液中的溶质物质的量浓度为 mol·L—1(保留小数点后3位数字);
⑵当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为 mL,所得溶液溶质物质的量浓度为 mol·L-1。
某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况),最后白色沉淀逐渐减少并最终消失;另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子和一种阴离子是。
(2)试通过计算确定该结晶水合物的化学式。
(3)写出加入过量的Ba(OH)2溶液发生的离子反应方程式:;
(4)假设过程中向该溶液中加入的Ba(OH)2溶液的物质的量浓度为2.0mol·L-1。则加入mL Ba(OH)2溶液时,所得沉淀的总物质的量最大。
实验室要配制1mol/L的稀硫酸250mL,回答下列问题:
(1)需要量取98%密度为1.84g/cm 3的浓硫酸mL
3的浓硫酸mL
(2)配制时,必须使用的仪器有 (填代号)
①烧杯 ②100 mL量筒 ③20 mL量筒 ④1000 mL容量瓶
⑤250 mL容量瓶 ⑥托盘天平(带砝码) ⑦玻璃棒
还缺少的仪器是 。
(3)配制时,该实验两次用到玻璃棒,其作用是。
(4)配制过程中出现以下情况,对所配溶液浓度有何影响(填“偏高”“偏低”“不影响”)
①没有洗涤烧杯和玻璃棒。 。
②如果加水超过了刻度线,吸出水使液面恰好到刻度线。 。
③容量瓶清洗完后没有干燥。
有机物A1和A2分别和浓H2SO4在一定温度下共热都只生成烃B,B的蒸气密度是同温同压下H2密度的59倍,在催化剂存在下,1mol B可以和4mol H2发生加成反应,B的一元硝化产物有三种(同种类型)。有关物质之间的转化关系如下: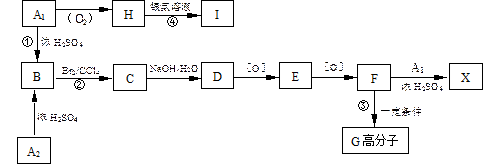
(1)反应①属于反应,反应②属于反应
(2)写出A2物质的结构简式:
A2
(3)书写化学方程式:
③
④
(4)化合物E有多种同分异构体,其中属于酯类且具有两个对位侧链的同分异构体有四种,分别写出它们的结构简式: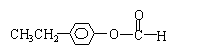
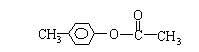
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)
 CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是(选填序号)。
A体系 的压强不再发生变化
的压强不再发生变化
B v正(CO)=v逆(H2O)
C生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将(填写不变.变小.变大)。
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将(填写不变.变小.变大)。
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量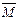 的取值范围是。
的取值范围是。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为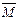 1),分别给出
1),分别给出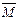 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
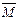 1的取值 1的取值 |
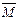 的变化 的变化 |
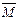 1<12 1<12 |
|
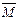 1=12 1=12 |
不变 |
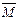 1>12 1>12 |
某无色溶液,其中可能存在如下离子:Na+.Ag+.Ba2+.Al3+.AlO2―.S2―.CO32―.SO32―.SO42―,现取该溶液进行有关实验,结果与下图所示。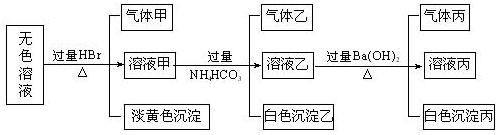
试回答下列问题:
(1)生成沉淀甲的离子方程式为。
(2)由溶液甲生成沉淀乙的离子方程式。
(3)沉淀丙是。如何用一化学实验来确定其成分
(4)气体甲的成分有哪几种可能。
(5)综合上述信息,可以肯定存在的离子有,一定不存在的离子是,可能存在的离子是。