现有25℃101KPa条件下的氯化氢(HCl)气体49L(注:25℃101KPa条件下气体摩
尔体积为24.5L/mol)则:
①该气体所含原子总数为________________个。
②该气体的质量为_____________g。
③该气体溶于127mL水中,得到密度为1.20g/mL的盐酸,此盐酸的物质的量浓度为______________。④取出20.0 mL该溶液,配成浓度为2.00 mol/L的稀溶液,则稀释后溶液的体积是_________ ml。
聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n·XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出。其制备原料主要是铝加工行业的废渣——铝灰,它主要含Al2O3、Al,还有SiO2等杂质。聚合氯化铝生产的工艺流程如下: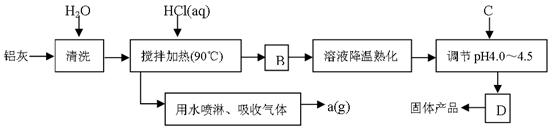
|
(1)搅拌加热操作过程中发生反应的离子方程式为: ;
。
(2)生产过程中B和D的操作名称分别是 和 (B和D均为简单操作)。
(3)反应中副产品a是 。
(4)生产过程中可循环使用的物质是 (用化学式表示)。
(5)调节pH至4.0~4.5的目的是 。
(6)实验室要测定水处理剂产品中n和x的值。为使测定结果更准确,需得到的晶体较纯净。生产过程C物质可选用 。
| A.NaOH | B.Al | C.氨水 | D.Al2O3 E.NaAlO2 |
电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式;
在X极附近观察到的现象是。
②Y电极上的电极反应式为,
检验该电极反应产物的方法是。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是,电极反应式是。
②Y电极的材料是,电极反应式是。
(说明:杂质发生的电极反应不必写出)
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示.
①该电解槽的阳极反应式是____________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因
___________________________________________________________________________。
③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出。
右图是部分化学常见的氧化物和单质的转化关系。其中。气化物f是制造光导纤维的重要原料,氧化物c是一种具有磁性的黑色物质。回答下列问题: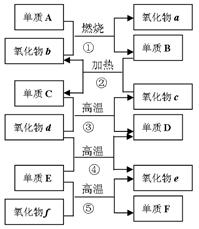
(1)写出下列物质的化学式:单质C,氧化物d;
(2)纯净的单质F在工业上的重要应用是;
(3)写出下列反应的化学方程式:
①;
④;
⑤。
复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值: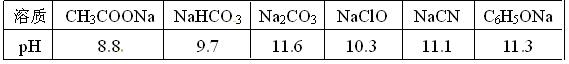 复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是___________(填编号)。
| A.CO2+H2O +2NaClO=Na2CO3+2HClO |
| B.CO2+H2O +NaClO=NaHCO3+HClO |
C.CO2 +H2O +C6H5ONa NaHCO3+C6H5OH NaHCO3+C6H5OH |
D.CO2 +H2O +2C6H5ONa Na2CO3+2C6H5OH Na2CO3+2C6H5OH |
E.Na2CO3+C6H5OH NaHCO3+C6H5ONa
NaHCO3+C6H5ONa
F.CH3COOH+NaCN=CH3COONa+HCN
(2)根据前述信息判断,常温下浓度均为0.05 mol/L的下列5种物质的溶液中,pH最小的是_____(填编号),其pH值为_______(填数值);pH最大的是____(填编号)。
①HCN②CH3COOH③HClO4④HClO⑤H2SO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
请根据上述反应,总结出复分解反应发生的另一规律:;
(4)根据(3)中结论,现将KI溶液和AgCl固体混合搅拌,则可能会观察到的现象是,反应的离子方程式为。
(1)配平氧化还原反应方程式:
C2O42-+MnO4-+H+=CO2+Mn2++H2O
(2)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25mol/LNaOH溶液至20mL时,溶液由无色变为浅红色。该溶液被中和的H+的总物质的量为mol。
②第二份溶液中滴加0.10mol/L的酸性高锰酸钾溶液至16mL时反应完全,此时溶液颜色由变为。该溶液中还原剂的总物质的量为mol。
③原试样中H2C2O4·2H2O的质量分数为。KHC2O4的质量分数为。