甲醇是重要的化学工业基础原料和清洁液体燃料。工业上可利用CO或CO2来生产燃料甲醇。已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
| 化学反应 |
平衡常数 |
温度℃ |
|
| 500 |
800 |
||
①2H2(g)+CO(g) CH3OH(g) CH3OH(g) |
K1 |
2.5 |
0.15 |
②H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) |
K2 |
1.0 |
2.50 |
③3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) |
K3 |
|
|
(1)反应②是 (填“吸热”或“放热”)反应。
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系,如图所示。则平衡状态由A变到B时,平衡常数K(A) K(B)(填“>”、“<”或“=”)。据反应①与②可推导出K1、K2与K3之间的关系,则K3= (用K1、K2表示)。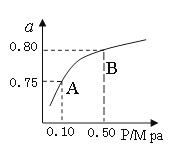
(3)在3 L容积可变的密闭容器中发生反应②,已知c(CO)与反应时间t变化曲线Ⅰ如图所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ。
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是 。
当曲线Ⅰ变为曲线Ⅲ时,改变的条件是 。
(4)甲醇燃料电池有着广泛的用途,同时Al-AgO电池是应用广泛的鱼 雷电池,其原理如图所示。该电池的负极反应式是 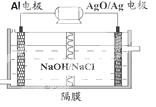
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。通常状况下,将a mol/L的醋酸与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)= c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为 。
V L Fe2(SO4)3溶液中,含有Fe3+ m g,则溶液中SO42-的物质的量浓度为__________________
一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是_______________
有A、B、C三瓶失去标签的无色溶液:K2CO3、BaCl2、NaOH。将它们分别与稀H2SO4作用,A产生白色沉淀,B产生无色气体,C中无明显现象。
则A是________,B是________ , C是________。
写出反应的化学方程式:
_______________________________________________________
实验室用98%的浓H2SO4(ρ="1.84" g·cm-3)配制1.5 mol·L-1稀H2SO4 溶液100 mL。
溶液100 mL。
(1)计算所需浓H2SO4体积为_________。
(2)量取所需浓H2SO4,应选用________________________。
(3)稀释浓H2SO4的方法(简要操作)_____________________________________________
(4)容量瓶使用前,检验其是否漏水的方法是_________________________________ ______
______
以下操作会引起最后所配溶液的浓度发生什么变化,请填写(偏高、偏低、无影响)
(5)稀释后的浓H2SO4若立即转移至容量瓶中,所配溶液的浓度将_________
( 6)容量瓶用蒸馏洗涤后残留有少量的水________________
6)容量瓶用蒸馏洗涤后残留有少量的水________________
(7)所用过的烧杯、玻璃棒未洗涤________________
(8)定容时俯视刻度线________________
(1) 49gH2SO4分子_________mol,含有O原子___________个。完全溶于水,配成2 L溶液,则所得溶液的物质的量浓度为_____________________。
(2)同温同压下,质量相同的五种气体: ① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________; 所含原子数由多到少的顺序是__________________________; 密度由大到小的顺序是_________________________________。