某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-(其中碳元素为+2价)、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中正确的是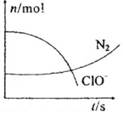
| A.还原剂是含CN-的物质,氧化产物只有N2 |
| B.氧化剂是ClO-,还原产物是HCO3- |
| C.配平后氧化剂与还原剂的化学计量数之比为5:2 |
| D.若生成2.24LN2(标准状况),则转移电子0.5mol |
下列关于判断过程的方向的说法正确的是()
| A.所有自发进行的化学反应都是放热反应 |
| B.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程 |
| C.高温高压下可以使石墨转化为金刚石是自发的化学反应 |
| D.同一物质的固、液、气三种状态的熵值相同 |
下列方程式书写正确的是()
A.NaHCO3在水溶液中的电离方程式:NaHCO3 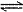 Na++HCO3- Na++HCO3- |
B.H2SO3的电离方程式H2SO3 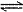 2H++SO32- 2H++SO32- |
C.CO32-的水解方程式:CO32-+2H2O  H2CO3+2OH- H2CO3+2OH- |
D.HS-的水解方程式:HS-+H2O  H2S+OH- H2S+OH- |
在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g) 2C(g),可以判断达到化学平衡状态的是( )
2C(g),可以判断达到化学平衡状态的是( )
| A.体系压强不变 | B.单位时间消耗n molA,同时生成2nmolC |
| C.A的转化率不变 | D.容器内气体密度不变 |
分别加热蒸干并灼烧(低于400℃)下列溶液,可以得到相应溶质的是
| A.氯化铜溶液 | B.硫酸亚铁溶液 | C.碳酸氢钠溶液 | D.硫酸铝溶液 |
在2L密闭容器中,发生3A(g)+B(g) ==2C(g)的反应,若最初加入A和B都是4mol,A的平均反应速率为0.12mol/(L·s),则10秒钟后容器中B的物质的量为()
| A.2.8mol | B.1.6mol | C.3.2mol | D.3.6mol |