中学常见反应的化学方程式是:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y是黄绿色气体,该反应的离子方程式是 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,其氧化产物的结构式为 ______
(3)若A为金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。
①A元素在周期表中的位置是 (填所在周期和族)
②含 a mol X的溶液溶解了一定量A后,若溶液中两种金属阳离子的物质的量恰好相等,被还原的X
是 mol。
(4)若A、B、X、Y均为化合物。向A溶液中加入硝酸酸化的AgNO3溶液,产生白色沉淀;B的焰色为黄色。则A与B按物质的量之比1:4反应后,溶液中溶质的化学式为 。
(15分)化学反应原理在工业生产中具有十分重要的意义。
(1)工业生产可以用NH3(g)与CO2(g)经两步反应生成尿素,两步反应的能量变化示意图如下:
则NH3(g)与CO2(g)反应生成尿素的热化学方程式为_______________。
(2)已知反应Fe(s)+CO2(g) FeO(s)+CO(g)ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
FeO(s)+CO(g)ΔH=a kJ·mol-1。测得在不同温度下,该反应的平衡常数K随温度的变化如下:
| 温度(℃) |
500 |
700 |
900 |
| K |
1.00 |
1.47 |
2.40 |
①该反应的化学平衡常数K的表达式为 ,a________0(填“>”、“<”或“=”)。在500 ℃ 2 L密闭容器中进行反应,Fe和CO2的起始量均为4 mol,则5 min后达到平衡时CO2的转化率为________,生成CO的平均速率v(CO)为_______________。
②700 ℃反应达到平衡后,要使反应速率增大且平衡向右移动, 可采取的措施有 。
(3)利用CO与H2可直接合成甲醇,下图是由“甲醇-空气”形成的绿色燃料电池的工作原理示意图,写出以石墨为电极的电池工作时负极的电极反应式 ,利用该电池电解1L 0.5mol/L的CuSO4溶液,当消耗560mLO2(标准状况下)时,电解后溶液的pH=(溶液电解前后体积的变化忽略不计)。
非金属元素H、C、O、S、Cl能形成的化合物种类很多,单质及化合物的用途很广泛。
(1)O2-的电子式为 ;
(2)O、Cl两元素形成的单质和化合物常用来杀菌消毒,试举例________(写化学式,任写两种);
(3)CH3OH在常温下为液态,沸点高于乙烷的主要原因是 ;
(4)Cl2是一种大气污染物,液氯储存区贴有的说明卡如下(部分):
| 危险性 |
 |
| 储运要求 |
远离金属粉末、氨、烃类、醇类物质;设置氯气检测仪 |
| 泄漏处理 |
NaOH、NaHSO3溶液吸收 |
| 包装 |
钢瓶 |
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用 。
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
③将Cl2通入适量KOH溶液中,产物中可能有KCl、KClO、KClO3。当溶液中c(Cl-): c(ClO-)="11" : 1时,则c(ClO-):c(ClO3-)比值等于 。
(5)镁是一种较活泼的金属, Mg与Ca类似,也能与C形成某种易水解的离子化合物。已知该化合物0.1mol与水完全反应后,产生0.1mol的某种气体。该气体被溴水全部吸收后,溴水增重2.6g。请写出该水解反应方程式 。
由熔盐电解法获得的粗铝含一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去,产生的尾气经处理后可用于钢材镀铝。工艺流程如下:
(注:NaCl熔点为801 ℃;AlCl3在181 ℃升华)
(1)精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为:
①____________
②____________。
(2)将Cl2连续通入坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除Cl2外还含有_________;固态杂质粘附于气泡上,在熔体表面形成浮渣,浮渣中肯定存在__________。
(3)在用废碱液处理气体A的过程中,所发生反应的离子方程式为:________________。
(4)镀铝电解池中,金属铝为________极。熔融盐电镀液中铝元素和氯元素主要以AlCl4-和Al2Cl7-形式存在,铝电极的主要电极反应式为___________。
(5)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,其原因是______________。
现有A、B、C、D、E、F六种化合物,已知它们的阳离子分别是K+、Ag+、Ca2+、Ba2+、Fe2+、Al3+,阴离子分别是Cl-、OH-、CH3COO-、NO3-、SO42-、CO32-,将它们分别配成0.1 mol/L的溶液,进行如下实验:
①测得溶液A、C、E呈碱性,且碱性为A>E>C;
②向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
③向D溶液中滴加Ba(NO3)2溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应现象所涉及的离子方程式是_____ ________。
(2)E溶液中溶质的名称是___________,判断依据是__________。
(3)写出下列四种化合物的化学式:
A:_______________ C:_____________ D:_______________ F:_______________
化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E 和H在一定条件下合成: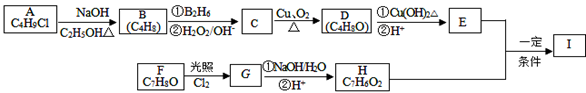
已知:①A的核磁共振氢谱表明其只有一种化学环境的氢;
②RCH=CH2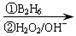 RCH2CH2OH
RCH2CH2OH
③化合物F苯环上的一氯代物只有两种;
④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的化学名称为 ;
(2)D的结构简式为 ;
(3)I的结构简式为 ;
(4)写出下列反应的类型:A→B: ;C→D: _____________
(5)F生成G的化学方程式为:_______________;
(6)I的同系物J比I相对分子质量小14,J能同时满足如下条件:①苯环上只有两个取代基,②能发生银镜反应,③能和饱和NaHCO3溶液反应放出CO2;符合上述条件的同分异构体共有 种(不考虑立体异构)。若J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式_______________。