可逆反应A(g)+3B(g) 2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
2C(g) ΔH=-QkJ/mol。有甲、乙两个容积相同且不变的密闭容器,向甲容器中加入1 mol A和3 mol B,在一定条件下达到平衡时放出热量为Q1kJ;在相同的条件下,向乙容器中加入2 mol C达到平衡后吸收热量为Q2 kJ;已知Q1=3Q2。下列叙述不正确的是
A.甲中A的转化率为75% B.Q1+Q2=Q
C.达到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正向移动
D.乙中的热化学方程式为2C(g) A(g)+3B(g) ΔH=+Q2 kJ/mol
A(g)+3B(g) ΔH=+Q2 kJ/mol
下列除去杂质中,所有的除杂试剂不正确的是( )
| 序号 |
主要成分 |
杂质 |
所用除杂试剂 |
| A |
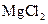 |
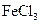 |
 |
| B |
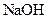 |
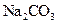 |
盐酸 |
| C |
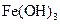 |
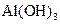 |
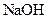 溶液 溶液 |
| D |
工业用水 |
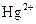 |
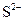 |
MOH强碱溶液和等体积、等物质的量浓度的HA弱酸溶液混合后,溶液中有关离子的浓度应满足的关系是( )
A. |
B. |
C. |
D. |
物质的量浓度相同的三种盐NaX、NaY和NaZ的溶液,其PH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
| A.HX,HZ,HY | B.HX,HY,HZ | C.HZ,HY,HX | D.HY,HZ,HX |
柠檬水溶液的PH是3,其中的 是( )
是( )
下列说法中正确的是( )
A.如果盐酸的浓度是醋酸的两倍,则盐酸中的 浓度也是醋酸中的两倍 浓度也是醋酸中的两倍 |
B.将 溶液和氨水各稀释一倍,两者的 溶液和氨水各稀释一倍,两者的 浓度均减小到原来的 浓度均减小到原来的 |
| C.中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠多于醋酸 |
| D.弱电解质溶液的导电能力也可能比强电解质溶液的强 |