按要求填空: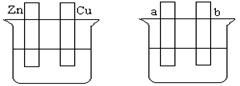
A B
(1)在A图中,稀硫酸为电解质溶液,用导线连接后,铜片电极反应式 。
(2)在B图中外接直流电源,若要在a极镀铜,加以必要的连接后,该装置叫 ,b极电极反应式 。
(3)在B图中外接直流电源,若电极为惰性电极,电解质溶液是CuSO4溶液(足量),电解总反应离子方程式为 ,阴极增重3.2 g,则阳极上放出的气体在标准状况下的体积是_____L,加入一定量的 后(填化学式),溶液能恢复至与电解前完全一致。
下表是元素周期表的一部分,列出了七种元素的周期表中的位置:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
① |
② |
③ |
||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
请用化学符号按要求回答下列问题:
(1)这七种元素中,非金属性最强的是,在元素周期表中的位置
(2)元素①与②形成摩尔质量为44g /mol的物质,它的电子式是
(3)③、⑥、⑦三种元素的原子半径由大到小的顺序是。
(4)④元素最高价氧化物对应的水化物与⑥元素的最高价氧化物对应的水化物反应的化学反应方程式是
(5)④、⑤、⑥三种元素最高价氧化物的水化物碱性强弱顺序是
Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布为msnmpn;
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙d.稳定性:甲<乙,沸点:甲>乙
(3)R元素的气态氢化物丙的沸点比同主族下一周期的元素气态氢化物高很多,原因是:________________________________________________;丙的空间构型________,杂化轨道类型________。
(4)Q、R、X三种元素的第一电离能数值由小至大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其分子中σ键与π键键数之比为________。
具有水果香味的中性物质A可以发生下列变化:
(1)推断下述物质的结构简式:
A:________________ B:________________
C:________________ D:________________
(2)写出下列变化的化学方程式:
A+NaOH→B+C:_________________________________反应类型___________
C→G:____________________________________反应类型___________
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。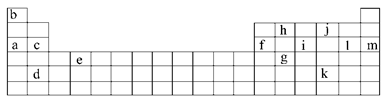
(1)下列__________(填写编号)组元素的单质具有良好导电性。
①a、c、h ②b、g、k ③c、h、i ④d、e、f
(2)下表是一些气态原子失去核外不同电子所需的能量,(即电离能,单位为kJ·mol-1):
| 电离能 |
锂 |
X |
Y |
| I2 |
519 |
502 |
580 |
| I2 |
7 296 |
4 570 |
1 820 |
| I3 |
11 799 |
6 920 |
2 750 |
| I4 |
9 550 |
11 600 |
①为什么锂原子的第二电离能远远大于第一电离能
________________________________________________________________________。
②表中X可能为以上13种元素中的__________(填写字母)元素。用元素符号表示X和j形成化合物的化学式_________________________________________________________。
③Y是周期表中__________族元素。
④以上13种元素中,_______(填写字母)元素原子失去核外第一个电子需要的能量最多。
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
(1)该物质的结构简式为________________.
(2)该物质中所含官能团的名称为______________.
(3)下列物质中,与该产品互为同系物的是(填序号)__________,互为同分异构体的是________.
①CH3CH===CHCOOH ②CH2===CHCOOCH3
③CH3CH2CH===CHCOOH ④CH3CH(CH3)COOH