合成氨反应N2(g)+3H2(g) 2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。
2NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成17 g NH3(g),放出46.1 kJ的热量。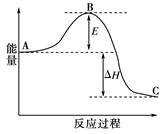
请回答下列问题:
(1)该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),E的大小对该反应的反应热有无影响?_ _。理由是_________ ;
(2)图中ΔH=________kJ·mol-1;
(3)起始充入2mol·L-1 N2和5.5 mol·L-1 H2,经过50 min,NH3的浓度为1mol·L-1,
则v(N2)=____________mol·L-1·min-1、C(H2)=______________mol·L-1;
已知NH3(g)= NH3 (l) ΔH=-QkJ·mol-1,书写N2(g)+3H2(g)=2NH3 (l)的热化学方程式 ________ 。
铁及铁的化合物在生产、生活中有着重要的用途。
(1) 已知铁是26号元素,写出Fe的价层电子电子排布式________。已知自然界丰度最大的铁的同位素是中子数为30的铁原子,则该种同位素符号________。
(2) Fe原子或离子外围有较多能量相近的空轨道,因此能与一些分子或离子形成配合物,则与之形成配合物的分子的配位原子应具备的结构特征是________。Fe(CO)3一种配合物,可代替四乙基铅作为汽油的抗爆震剂,其配体是CO分子。写出CO的一种常见等电子体分子的结构式________;两者相比较,沸点较髙的是________填分子式)。
(3) 1183K以下纯铁晶体的晶胞如图1所示,1183K以上则转变为图2所示晶胞,在两种晶体中最邻近的铁原子间距离相同。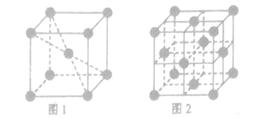
①图1和图2中,铁原子的配位数之比为________。
②空间利用率是指构成晶体的原子、离子或分子在整个晶体空间中占有的体积百分比,则图1和图2中,铁原子的空间利用率之比为________。
琉酸是无机“三大强酸"之一,其产量是衡量一个国家无机化工发展水平的重要标志。工业制硫酸的工艺流程如下图: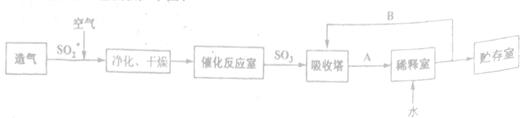
据图回答下列问题:
(1)写出用黄铁矿(主要含FeS2)造气的化学反应方程式________。
(2) 给出A、B物质的名称:A________,B________
(3) 催化氧化之前对SO2和空气的混合气体进行净化、干燥的目的是________ 选用B进入吸收塔吸收SO3的优点是________。
(4) SO2的催化氧化是一个可逆反应,采取适宜的反应条件有利于生产的进行。实际生产中,下列哪些生产条件或措施考虑到了平衡移动原理________ (选填序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.催化反应室中选择400-5000C温度
D.净化后的炉气中要有过量的空气
E. 催化氧化在常压下进行
F. 将尾气中的SO2循环利用
(5) 某硫酸厂每天消耗黄铁矿石(含FeS2质量分動60%) 20吨,生产的三阶段的转化率依次为98%、95%、98%,则该工厂一天能生产B的质量为__________吨。
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1) 实验室制备氨气的化学反应方程式为_________。
(2) 工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。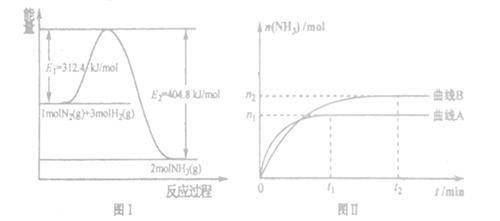
下列说法正确的是_______。
| A.ΔH=-92.4kJ/mol |
| B.使用催化剂会使E1的数值增大 |
| C.为了提高转化率,工业生产中反应的浓度越低越好 |
| D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB |
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KA<KB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为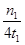 mol/(L·min)
mol/(L·min)
(3) —定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的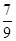 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(4)已知H2(g)的燃烧热为285.8 kJ/mol,试写出表示NH3(g)燃烧热的热化学反应方程式_____。以氨气为燃料可以设计制氨燃料电池(电极材料均为惰性电极,KOH溶液作电解质溶液)该电池负极电极反应式为_______经測定,该电作过程中每放出1molN2实际提供460kJ的电能,则该燃料电池的实际效率为_____(燃料电池的实标效率是指电池实际提供的电能占燃料电池反应所能释放出的全部能量的百分数)
将1.000gFeC2O4·2H20固体样品放在热重分析仪中进行热重分析,測得其热重分析曲线(样品质量随温度变化的曲线)如下图所示:
已知:①草酸盐受热分解易放出碳的氧化物。②5000C之前,该热重分析仪的样品池处于Ar气气氛中,5000C时起,样品池与大气相通。完成下列填空:
(1)3000C时是样品脱水的过程,试确定3500C时样品是否脱水完全_____ (填“是"或否“),判断的理由是____(要求写出推算过程)。
(2 ) 4000C时发生变化的化学方程式是_______。
(3) 将6000C时样品池中残留的固体隔绝空气冷却至室温,再向该固体中加入一定量的稀盐酸刚好完全溶解,用pH试纸测得所得溶液的PH=3,其原因是____(用离子方程式回答):向该溶液中滴加适量NaOH溶液生成红褐色沉淀,測得此时溶液中铁元索的离子浓度为4.0x10-11mol/L,则此时溶液的pH=_______(已知:Ksp[Fe(OH)2]=8.0×10-16,Ksp[Fe(OH)3]=4.0×10-38)
(4) 将15000C时样品池中残留的固体隔绝空气冷却后,用稀盐酸溶解得一棕黄色溶液。取少量该溶液滴加KSCN,溶液显红色;另取少量该溶液滴加K3[Fe(CN)6)(铁氰化钾)溶液,产生特征蓝色沉淀。试写出图中14000C时发生反应的化学方程式_________ ,产生特征蓝色沉淀的离子反应方程式______。
桂皮酸是一种可从安息香分离出的有机芳香酸,其苯环上只有一个取代基。桂皮酸甲酯可用作定香剂,用于饮料、冷饮、糖果、酒类等食品。G为桂皮酸甲酯的一种同分异构体,其分子结构模型如右图所示(图中球与球之间连线表示单键或双键)。用烃A 为原料合成G的路线如下: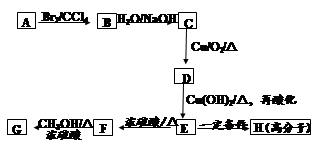
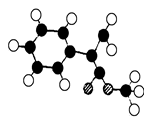
(1)桂皮酸结构简式为:;分子中核磁共振氢谱共有个峰;
(2)化合物D可以发生的反应有。
| A.取代反应 | B.氧化反应 | C.还原反应 | D.水解反应 |
(3)写出化学方程式
①C→D ____________________________
②E→H ____________________________
(4)其中E的同分异构体甚多,其中有一类可用通式 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式、、、。
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应的四种物质的结构简式、、、。