(1)如图是课本中“四种基本反应类型与氧化还原反应的关系”图,“H2+CuO  Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。
Cu+H2O”反应属于图中的区域 (填序号)。下列反应中属于区域7的有 。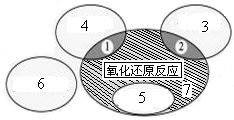
A.2H2+O2 2H2O 2H2O |
B.2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑ |
| C.Zn+H2SO4=ZnSO4+H2↑ |
D.CuO+CO Cu+CO2 Cu+CO2 |
(2)某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知:该反应中H2O2只发生如下过程:H2O2→O2。
①该反应中,发生还原反应的物质是 。
②写出该反应的化学方程式(不用配平)
_________+________ → ________+________+________
(3)3Cl2+8NH3 N2+6NH4Cl
N2+6NH4Cl
①用双线法表示该反应转移的电子数目和方向。
②该反应中,氧化剂与还原剂分子个数之比为 。
(4)在一定条件下,PbO2与Cr3+反应,产物是Cr2O72—和Pb2+。若与1molCr3+完全反应所需PbO2的物质的量为 。
物质的量相等的CO和CO2中,分子个数之比为;原子个数之比为;氧原子个数比为。在温度和压强相等的条件下,氧气和氢气的密度比为,质量相等时的体积比为,体积相等时的物质的量之比为。
1mol H2SO4中含mol硫原子,个氧原子。
28g KOH配成250mL溶液,溶质的物质的量,溶质的物质的量浓度为。
100mL 1 mol/LAl2(SO4)3溶液中,Al3+物质的量浓度是,含Al3+物质的量mol,从其中取10ml,Al2(SO4)3物质的量浓度是,再将这10ml溶液稀释成100ml,物质的量浓度又为。Al3+与SO42-物质的量浓度之比是。
6.02×1022个CO2分子的物质的量为,质量为,标准状况下的体积为,含有氧原子的物质的量为。