同温同压下,等质量的O2和O3相比较,下列结论正确的是( )
| A.它们的分子数目之比是 1∶1 | B.它们的氧原子数目之比为 2∶3 |
| C.它们的密度之比为 2∶3 | D.它们的体积之比是 1∶1 |
将100 mL稀硝酸和稀硫酸的混合酸溶液平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g(假设此时硝酸只被还原为NO,下同);向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化如图所示。则下列判断中错误的是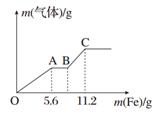
| A.OA段产生的气体是NO,BC段产生的气体是H2 |
| B.A点对应消耗NO3-物质的量为0.1 mol |
| C.B点对应消耗铁粉的质量为8.4 g |
| D.原混合酸溶液中H2SO4的浓度为2.0 mol·L-1 |
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑.A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是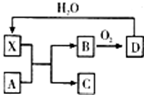
| A.X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可以观察到有白色沉淀产生 |
| D.工业上,B转化为D的反应条件为高温、常压、使用催化剂 |
有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol・L-1,c(Cl-)为1.3mol・L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol・L-1NaOH溶液的体积为
| A.40mL | B.72mL | C.80mL | D.128mL |
下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是
| A.取a g混合物充分加热,减重b g |
| B.取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体 |
| C.取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g |
| D.取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体 |
200℃时,11.6g由CO2和水蒸气的混合物与足量的Na2O2充分反应后,固体质量增加了3.6g,则原混合气体的平均摩尔质量为()g/mol
| A.5.8 | B.11.6 | C.23.2 | D.46.4 |