工业上合成氨的热反应方程式如下:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
(1)若已知破坏1mol 键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
键、H—H键键分别需吸收的能量为946 kJ、436 kJ,则断开1molN—H需吸收的能量为 kJ。
(2)在恒温恒压的条件下,将2mol N2和6molH2通入一容积可变的容器中反应,达到平衡后气体的体积为反应前的75%,则该过程释放的能量为 kJ,氮气的转化率为 ,平衡后氨气占混合气体的体积分数为 。
(3)若将1mol N2和1molH2通入两个相同体积的密闭容器甲和乙中,甲容器保持温度和体积不变,乙容器保持温度和压强不变,经过一段时间后,两容器均达到平衡状态。
①建立平衡所需的时间:甲 乙(填“>”,“<”或“=”)
②达到平衡后氨气的体积分数:甲 乙(填“>”,“<”或“=”)
(1 0分)汽车尾气中含有CO、NO2
0分)汽车尾气中含有CO、NO2 等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
(1)汽油在不同空/燃比(空气与燃油气的体积比)时尾气的主要成分不同,空/燃比较小时的有毒气体主要是 ▲(填化学式)。
(2)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式:
N2(g)+O2(g)=2NO(g)ΔH=+180 kJ·mol-1
N2(g)+2O2(g)=2NO2(g)ΔH=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
C(s)+O2(g)=CO2 (g) ΔH=-393.5 kJ·mol-1
(g) ΔH=-393.5 kJ·mol-1
① 一定条件下,N2与O2反应生成NO能够自发进行,其原因是 ▲;NO分子中化学键的键能为 ▲kJ·mol—1。
② CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g) ΔH= ▲。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲
ΔH= ▲。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 ▲ (填代号)。
(填代号)。
CYP73A1炔抑制剂的合成路线如下: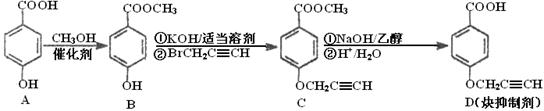
(1)化合物A核磁共振氢谱有______▲______种蜂。
(2)化合物C中含氧官能团有_______▲________、_______▲_______(填名称)。
(3)鉴别化合物B和C最适宜的试剂是____________▲________。
(4)写出A—B的化学方程式_______________▲______________。
(5)B的同分异构体很多,符合下列条件的异构体有_______▲_______种。
①苯的衍生物②含有羧基和羟基 ③分子中无甲基
(6)试以苯酚、氯乙酸钠(ClCH2COONa)、正丁醇为原料(无机试剂任用),结合题中有关信息,请补充完整的合成路线流程图。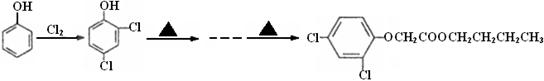
无水AlCl3易升华,可用作有机合成的催化剂等。工业 上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
上由铝土矿(A12O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下。
(1)氯化炉中Al2O3、C12和C反应的化学方程式为▲。
(2)用Na2SO3溶液可除去冷却器排出尾气中的Cl2,此反应的离子方程式为▲ 。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是▲。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3) 的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,残留固体质量为0.32 g。
①写出除杂过程中涉及的离子方程式 ▲、 ▲。
②AlCl3产品的纯度为▲ 。
(5)工业上另一种由铝灰为原料制备无水AlCl3工艺中,最后一步是由AlCl3·6H2O脱水制备无水AlCl3,实现这一步的方法是 ▲。
(12分)在100 ℃时,将0.40 mol二氧化氮气体充入2 L抽空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间(s) |
0 |
20 |
40 |
60 |
80 |
| n(NO2)/mol |
0.40 |
n1 |
0.26 |
n3 |
n4 |
| n(N2O4)/mol |
0.00 |
0.05 |
n2 |
0.08 |
0.08 |
⑴在上述条件下,从反应开始直至20 s时,二氧化氮的平均反应速率为_________mol/(L·min)。
⑵此条件下该反应的化学平衡常数的值约为___________(保留两位有效数字)。
⑶若达到平衡后,降低温度,气体颜色会变浅,则该反应的平衡常数将____________(填“增大”、“减小”或“不变”)。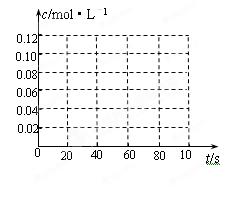
⑷若在相同情况下最初向该容器中充入的是N2O4气体,要达到初始数据表中同样的平衡状态,N2O4的起始浓度是_______________;假设在80 s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线。
⑸计算⑷中条件下达到平衡后N2O4的转化率__________________。
(1) 25℃时,在酸性、碱性、中性溶液中,C(H+)·C(OH-)=。
某温度下纯水中的C(H+)= 2×10-7mol/L,则此时溶液中的C(OH-)=mol/L;若温度不变,滴入稀盐酸,使c(H+)= 5×10-4mol/L,则溶液中C(OH-)=mol/ L,pH= .
L,pH= .
(2) 室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液 体积的变化),测得混合溶液的pH=6,试回答以下问题:
体积的变化),测得混合溶液的pH=6,试回答以下问题:
① 混合溶液中水电离出的c(H+)________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
② 求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1c(H+)-c(MOH) =__________ mol·L-1
(3) 室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(4)室温下,pH=13的强碱溶液与pH=2的强酸溶液混合,所得溶液的pH=7,则强碱与强酸的体积比是