利用废的生铁丝(表面有铁锈)、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下图: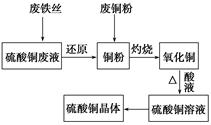
试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,其目的是__________________,可能发生反应的离子方程式有Fe+2H+=Fe2++H2↑、_____________________、__________________。
(2)废铜粉与还原所得铜粉混合灼烧,检验发现灼烧后得到的是CuO和少量Cu的混合物。原因是:
①灼烧不充分Cu未被完全氧化。
②CuO未被还原。还原剂是_______________。
(3)为了使灼烧后的混合物充分酸溶,在加入稀H2SO4的同时,也加入适量的H2O2溶液,并控温在50~60℃,持续反应1h。请回答下列问题:
①反应时温度必须控制在50~60℃,温度不宜过高,这样操作的目的_____;
②写出反应的化学方程式:_____________、________________________________。
(4)由硫酸铜溶液得到硫酸铜晶体的实验操作为________________________。
(5)直接向灼烧后的混合物中加入浓硫酸并加热进行酸溶,也可达到充分酸溶的目的,但实际操作中较少使用,原因可能是_________________。
下表为元素周期表的一部分,请回答有关问题:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
||||||
| 3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
| 4 |
⑨ |
⑩ |
(1) ⑤ 和 ⑧ 的元素符号是_________和_________.
(2) 此表中最活泼的金属是_________,非金属性最强的元素是______(填写元素符号).
(3)在 ③ ~ ⑦ 元素中,原子半径最大的是 (填写元素符号)。
(4)表中能形成两性氢氧化物的元素是_________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:______________________;_____________________ .
用“>”或“<”填空:
(1)酸性:H2CO3___________H2SiO3,H2SiO3___________H3PO4。
(2)碱性:Ca(OH)2___________Ba(OH)2,Mg(OH)2___________Al(OH)3
(3)气态氢化物稳定性:NH3___________ H2O, H2S ___________ HCl
(4)还原性:HCl ___________HBr,H2S___________HCl
(5)酸性:H2SO4___________H2SO3,HClO ___________ HClO4
某元素的原子具有3个电子层,最外电子层上有5个电子,它的最高价氧化物的化学式是________,最高价氧化物对应的水化物的化学式是________.
当一个化学反应中反应物总能量大于生成物总能量时,此反应为__________反应(吸热或放热),酸碱中和是____________反应(吸热或放热)。
同位素的化学性质性质几乎。(相同或不同)