如图甲、乙是电化学实验装置。有关电极反应或计算错误的是:
| A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-= 4OH- |
| B.若乙烧杯中盛有则乙中的总反应为 |
| C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-=Fe2+ |
| D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6 g CuO |
同温同压下,甲容器充满35Cl2,乙容器中充满37Cl2,下列叙述不正确的是()
| A.若两种气体体积相等,甲、乙两容器中气体的密度之比为35:37 |
| B.若两种气体体积相等,甲、乙两容器中气体分子数之比为35:37 |
| C.若两种气体质量相等,甲、乙两容器中气体所含质子数之比为37:35 |
| D.若两种气体体积相等,甲、乙两容器中气体所含中子数之比为9:10 |
多硫化钠Na2Sx在结构上与Na2O2,FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO的量之比为1:16,则x值是()
| A.5 | B.4 | C.3 | D.2 |
在100 g浓度为10 mol·L-1、密度为ρ g·cm-3的氨水中加入一定量的水稀释成5 mol·L-1的氨水,则加入水的体积为
| A.小于100 mL | B.等于100 mL | C.大于100 mL | D.等于(100/ρ)mL |
用 H2还原 x g CuO,当大部分固体变红时停止加热,冷却后得残留固体yg,共用掉z g H2,此时生成水的质量为()
| A.8 (x-y)/9 g | B.9 (x - y) /8 g |
| C.9 z g | D.9 z /40 g |
常温下,向0.1 mol·L-1的硫酸溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是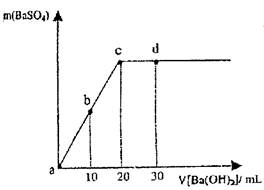
| A.c时刻硫酸溶液的体积为30 mL |
| B.b时刻溶液中SO42-的浓度约为0.5 mol·L-1 |
| C.d时刻溶液的OH-的浓度为0.04mol/L |
| D.溶液的导电能力:c<d="b<a" |