研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下: 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。
该工艺中物质D可以作为原料循环利用,它的化学式为 。
写出步骤②反应的离子方程式 。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为 。
Ⅰ.将由Na+、Ba2+、Cu2+、SO42-、Cl-组合形成的三种强电解质溶液,分别装入下图装置中的甲、乙、丙三个烧杯中进行电解,电极均为石墨电极。
接通电源,经过一段时间后,测得乙中c电极质量增加。常温下各烧杯中溶液pH与电解时间t的关系如右上图(忽略因气体溶解带来的影响)。据此回答下列问题: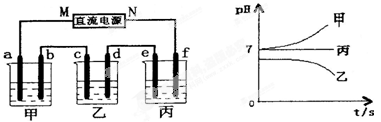
(1)在甲中烧杯中滴加酚酞,极(填a或b)附近溶液会变红。
(2)写出乙烧杯中发生反应的化学方程式。
(3)电极f上发生的电极反应式为。
(4)若经过一段时间后,测得乙烧杯中c电极质量增加了8g,要使丙烧杯中溶液恢复到原来的状态,应进行的操作是。
Ⅱ.工业上利用BaSO4制备BaCl2的工艺流程如下: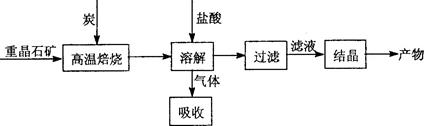
某活动小组的同学在实验室以重晶石(主要成分BaSO4)为原料,对上述工艺流程进行模拟实验。
(1)上述过程中,气体用过量NaOH溶液吸收得到Na2S。Na2S水溶液显碱性的原因是。(用离子方程式表示)
(2)已知有关反应的热化学方程式如下:
BaSO4(s) +4C(s) 4CO(g)+BaS(s)△H1 = +571.2kJ/mol①
4CO(g)+BaS(s)△H1 = +571.2kJ/mol①
C(s) +CO2(g) 2CO(g)△H2 = +172.5kJ/mol②
2CO(g)△H2 = +172.5kJ/mol②
则反应BaSO4(s) +2C(s) 2CO2(g) + BaS(s)△H3 =
2CO2(g) + BaS(s)△H3 =
(3)在高温焙烧重晶石过程中必须加入过量的炭,同时还要通入空气,其目的是。
某同学探究SO2有关性质。
(1)将SO2通入BaCl2溶液中,将所得溶液分成2份,在第一份中加入NaOH溶液,在第二份中滴入FeCl3溶液,两份都有白色沉淀。BaCl2溶液中通入SO2气体的现象为。在第二份溶液中滴入FeCl3溶液时,SO2表现性,反应的离子方程式为,生成沉淀的化学式为。
(2)下列不能用来吸收SO2气体的是。
| A.KMnO4(aq) | B.过量氨水 | C.石灰水 | D.盐酸 |
(3)工业废气含SO2为7%(体积分数),在同温同压下,将以上废气用废气中的O2氧化含SO3。反应后气体体积为原来气体的96.64%。则SO2的转化率为。
(4)硫原子33 16S的电子排布式为。
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,且互不重复:NH4+、Ba2+、Na+、H+、SO42-、NO3-、OH-、CO32-。将这四种溶液分别标记为A、B、C、D,进行如下实验:
①在A或D中滴入C,均有沉淀生成;②D和B反应生成的气体能被A吸收;③A和D反应生成的气体能被B吸收。试回答下列问题:
(1)D的化学式是,判断理由是。
(2)写出其余几种物质的化学式:A,B,C。
(3)写出实验②中有关反应的离子方程式,。
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 |
X |
Y |
Z |
W |
| 原子核数 |
单核 |
不同元素构成的两核 |
同元素构成的两核 |
同元素构成的两核 |
| 粒子的电荷数 |
0 |
0 |
两个负电荷 |
0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是。含lmolX的氧化物晶体中含有共价键数目为。
(2)Z与钙离子组成的化合物的电子式为。
(3)14gY完全燃烧放出的热量是141.5kJ,写出Y燃烧的热化学方程式。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(丁为金属单质,反应条件和其他物质已略)
①写出丁元素在周期表中的位置。
②写出丁在高温下与水反应的化学方程式。
③组成W的元素的简单氢化物极易溶于水的主要原因是,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH,其负极的电极反应式为。
已知:① ;②
;② ,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
,有机物A的水溶液显酸性,遇 FeCl3不显色,苯环上的一氯代物只有两种结构。试根据下图中各有机物的相互转化关系回答:
(1)写出下列物质的结构简式:
A________________________、L________________。
(2)上述物质中互为同分异构体的是_______________(填符号);
(3)上述变化中,属于缩聚反应的是_______;属于消除反应的是_______(均填反应编号);
(4)物质B用盐酸酸化可得到产物W,W的同分异构体中,既属于酚类,同时也属于酯类的化合物有____种,请写出其中一种同分异构体的结构简式___________________;
(5)上述反应中的HCHO可以用甲烷和必要的无机原料制备,写出反应的化学方程式________________________________________________________________。