G(异戊酸薄荷醇酯)是一种治疗心脏病的药物,可由A(分子式为C7H8O,能与FeCl3溶液发生显色反应)和烯烃D(分子式C4H8)等为原料制取,合成路线如下:
已知:①RCH=CH2+CO+H2 RCH2CH2CHO
RCH2CH2CHO
②

(1)A的名称为 。
(2)F中含氧官能团名称 和 。
(3)D的结构简式为 。
(4)B→C的化学方程式为 。
(5)某化合物是B的同分异构体,其核磁共振氢谱有4组峰且面积比为9∶2∶2∶1,写出该化合物的结构简式 (任写一种)。
(6)正戊醛可用作香料、橡胶促进剂等,写出以乙醇为原料制备CH3(CH2)3CHO的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: 
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3 H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成水和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式 。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH 7(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式 。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为 。
②产品室中生成亚磷酸的离子方程式为 。
已知醋酸和盐酸是日常生活中极为常见的酸。
(1)常温常压,在 pH=5的稀醋酸溶液中,c(CH3COO‾)=_____________;下列方法中,可以使0.10 mol/LCH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol/L的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol/L
e.加入少量氯化钠固体
f.加入少量0.10 mol/L的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)__________V(醋酸),反应的最初速率为:
υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va________Vb;溶液中各离子的浓度按照由大到小排序为_________。
(4)已知:90℃时,水的离子积常数为Kw=38×10‾14,在此温度下,将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=____________(保留三位有效数字)。
元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电子。元素Z的原子最外层电子数是其内层的3倍。
(1)X与Y所形成化合物晶体的晶胞如图所示。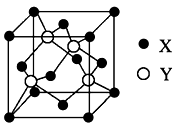
①在一个晶胞中,X离子的数目______;
②该化合物的化学式为______________;
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是____________;
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是____________;
(4)Y与Z可形成YZ42-。
①YZ42-的空间构型为____________(用文字描述);
②写出一种与YZ42-互为等电子体的分子的化学式____________;
(5)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有δ键的数目为________;
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl的晶胞如图所示,随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将NaCl固体研细、干燥后,准确称取m g NaCl固体并转移到定容仪器A中。②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度线,计算出NaCl固体的体积为V mL。回答下列问题:
(1)步骤①中仪器A最好用________________(填仪器名称)。
(2)你认为步骤②中是用_________(填“酸式”或“碱式”)滴定管,原因是________________。
(3)能否用胶头滴管代替步骤②中的滴定管__________,其原因是________________。
(4)经X-射线衍射测得NaCl晶体中相邻Na+和Cl-的核间距为acm.则利用上述方法测得的阿伏加德罗常数的数学表达式为NA=________________。
短周期主族元素X、Y、Z、W、Q的原子序数依次增大,X原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,Z的氧化物可做耐火材料,W的简单离子是同周期中离子半径最小的,Q的p能级上有一个未成对电子.试回答下列问题:
(1)比较第一电离能:Z_________W(填“>”、“<”或“=”,后同);电负性:X________Y。
(2)写出Q的价电子排布图_____________,YF3的结构式_____________,
(3)向硫酸铜溶液中逐滴滴入Y的氢化物的水溶液至过量,用离子方程式表示该过程出现的现象变化:答:________________________________________。