铜及其化合物在工农业生产及日常生活中应用非常广泛。
(1)由辉铜矿制取铜的反应过程为:
2Cu2S(s)+3O2 (g)=2Cu2O(s)+2SO2(g) △H=-768.2kJ·mol-1,
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2(g) △H=+116.0kJ·mol-1,
①热化学方程式:Cu2S(s)+O2(g)=2Cu(s)+SO2(g) △H= kJ·mol-1。
②获得的粗铜需电解精炼,精炼时粗铜作 极(选填:“阳”或“阴”)。
(2)氢化亚铜是一种红色固体,可由下列反应制备4CuSO4+3H3PO2+6H2O=4CuH↓+4H2SO4+3H3PO4。
①该反应还原剂是 (写化学式)。
②该反应每转移3mol电子,生成CuH的物质的量为 。
(3)氯化铜溶液中铜各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与c(Cl-) 的关系如图所示。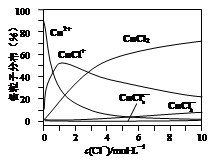
①当c(Cl-)=9mol·L-1时,溶液中主要的3种含铜物种浓度大小关系为 。
②在c(Cl-)=1mol·L-1的氯化铜溶液中,滴入AgNO3溶液,含铜物种间转化的离子方程式为 (任写一个)。
某温度下0.1 mol·L-1Na2CO3溶液中,c(Na+)/c(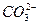 )=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(
)=20/9>2,其原因是(用离子方程式表示,下同)_________。现向Na2CO3溶液中通入一定量的CO2后,c(Na+)/c(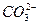 )=5/2>20/9,其原因是_________,此时c(
)=5/2>20/9,其原因是_________,此时c( )=_________。
)=_________。
现有电解质溶液:①Na2CO3②NaHCO3
③NaAlO2④CH3COONa⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为__________。
我国能源以煤为主,燃煤产生的二氧化硫的年排放量为1825吨,居世界首位。二氧化硫在湿度较大的大气中,在烟尘中的金属离子作用下会发生催化氧化反应,形成酸雾,其化学方程式是__________________________________________________________。
随着我国人民生活水平的不断提高,家用热水器走入寻常百姓家。目前家用热水器主要有电热水器和燃气热水器两种。燃气热水器又可分为天然气型、人工煤气型和液化石油气型等。
(1)某城市人工煤气是由水煤气和焦炉煤气混合而成的。写出由焦炭制取水煤气的化学方程式____________________________________________________________________________。
(2)将40 L 20 ℃冷水加热到80℃。若使用天然气热水器,则需要标准状况下____________L 甲烷(已知22.4 L甲烷燃烧放出890.4 kJ热量,假设甲烷燃烧时的热效率为60%,水的比热为4.18 kJ·kg-1·℃-1)。若使用电热水器,则需要通电___________分钟(假设电加热棒功率为1 500 W,热效率为80%)。
(3)煤气和电都是二次能源,制煤气和火力发电都要消耗能源,且产生大气污染物,未来的新型能源是_____________________________。
同素异形体相互转化的反应热相当小而且转化速率较慢,有时还很不完全,测定反应热很困难。现在可根据盖斯提出的“不管化学过程是一步完成还是分几步完成,这个总过程的热效应是相同的”观点来计算反应热。已知:
P4(s,白磷)+5O2(g)====P4O10(s)
ΔH="-2" 983.2 kJ·mol-1①
P(s,红磷)+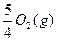 ====
====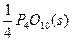
ΔH="-738.5" kJ·mol-1②
则白磷转化为红磷的热化学方程式为_________。相同状况下,能量状态较低的是_________;白磷的稳定性比红磷_________(填“高”或“低”)。