下列有关离子的说法正确的是
| A.H+、NO3-、Fe2+、Na+四种离子在溶液中能够大量共存 |
| B.Cl2通入水中的离子方程式:Cl2+H2O=2H++Cl-+ClO- |
| C.1mol Na2O2中含有2mol阳离子和1mol阴离子 |
| D.向某溶液中加入澄清石灰水变浑浊,再加入盐酸,变澄清且有无色无味气体产生,则原溶液中一定含有碳酸根离子 |
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g) CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是
CO2(g)+H2(g)。CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如下图所示。下列说法错误的是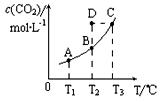
A.反应CO(g)+H2O(g) CO2(g)+H2(g)的△H>0 CO2(g)+H2(g)的△H>0 |
| B.在T2时,若反应进行到状态D,则一定有v正<v逆 |
| C.平衡状态A与C相比,平衡状态A的c(CO)小 |
| D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2 |
可逆反应:3A(g)  3B(?) + C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体 ②B和C一定都是气体 ③若C是固体,则B一定是气体 ④B和C可能都是气体
3B(?) + C(?);△H>0,随着温度升高,气体平均相对分子质量有变小趋势,则下列判断正确的是:①B和C可能都是固体 ②B和C一定都是气体 ③若C是固体,则B一定是气体 ④B和C可能都是气体
| A.①② | B.②③ | C.③④ | D.①④ |
在一个体积可变的密闭容器中,通入2molHI气体,在一定条件下建立如下平衡:2H1(g)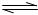 I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
I2(g)+H2(g);△H>0,测得平衡时容器体积为1L,c(I2)=0.5mol/L。改变相关条件,下列结论正确的是
| A.保持容器体积不变,升高温度,混合气体的颜色逐渐变浅 |
| B.保持容器体积与温度不变,充入一定量氦气(不参与反应),则正反应速率和逆反应速率均增大 |
| C.保持温度不变,缓慢压缩容器,使容器体积恒定为0.2L,一定时间后,测得c(I2)=25mol/L |
| D.保持容器压强和温度不变,再通入2molHI气体,到达平衡状态后,测得HI的转化率为60% |
一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率但不影响生成H2的总量,可向
盐酸中加入适量的
| A.CaCO3(s) | B.Na2SO4溶液 | C.KNO3溶液 | D.CuSO4(s) |
下列分离或提纯物质的操作方法正确的是
①除去KNO3晶体中混有少量的NaCl晶体:冷却结晶
②除去NaCl晶体中混有少量的KNO3晶体:蒸发结晶
③分离含碘的苯溶液:蒸馏
| A.仅有② | B.仅有①③ | C.仅有②③ | D.①②③ |