合成氨反应为:N2(g)+3H2(g) 2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)。图1表示在一定的温度下此反应过程中的能量的变化,图2表示在2L的密闭容器中反应时N2的物质的量随时间的变化曲线。图3表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。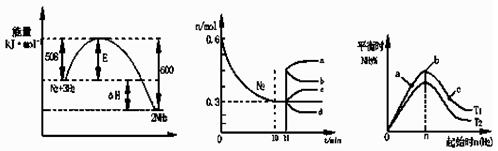
图1图2图3
下列说法正确的是:
| A.该反应为自发反应,由图1可得加入适当的催化剂,E和△H都减小 |
| B.图2中0~10min内该反应的平均速率v(H2)=0.045mol·L-1·min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d |
| C.图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 |
| D.图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是
| A.铜片、铁片、FeCl3溶液组成的原电池 |
| B.石墨、铁片、Fe(NO3)3溶液组成的原电池 |
| C.铁片、锌片、Fe2(SO4)3溶液组成的原电池 |
| D.铜片、铁片、Fe(NO3)3溶液组成的原电池 |
在298K、100kPa时,已知:①、2H2O(g)=O2(g)+2H2(g) ΔH1
②、Cl2(g)+H2 (g)=2HCl(g) ΔH2
③、2Cl2(g)+2 H2O (g)=4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
在0.1mol/L的CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO-+H+,对于该平衡,下列叙述正确的是
CH3COO-+H+,对于该平衡,下列叙述正确的是
| A.加入少量NaOH固体,平衡向逆反应方向移动 |
| B.升高温度,平衡向正反应方向移动 |
| C.加入水稀释,溶液中c(H+)一定增大 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
将等质量的两份锌粉a、b分别加入过量的稀硫酸。同时向a中加入少量CuSO4溶液。图中产生H2的体积V L与时间t min的关系正确的是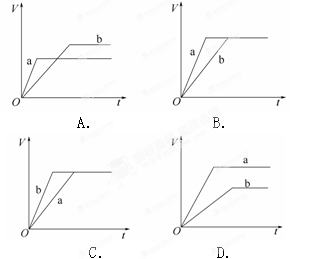
0.1mol/L的K2S溶液中,有关粒子的浓度大小关系正确的是
| A.c(K+)+c(H+)=c(S2—)+c(HS—)+c(OH—) | B.c(H+)= c(OH—) |
| C.c(K+)=c(S2—)+c(HS—)+c(H2S) | D.c(OH-)=c(H+)+c(HS—)+2c(H2S) |