在一密闭容器中,反应aA(g) bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
bB(g),达到平衡后,保持温度不变,将容器体积增加1倍,当达到新的平衡时,B的浓度是原来的70%,则
| A.平衡向逆反应方向移动了 | B.物质A的转化率减小了 |
| C.物质B的质量分数增加了 | D.化学计量数关系:a>b |
10mL一定物质的量浓度的盐酸X,用一定物质的量浓度的NaOH溶液Y滴定的图示。依据图示,推出X和Y的物质的量浓度是()
| A |
B |
C |
D |
|
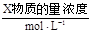 |
0.12 |
0.04 |
0.03 |
0.09 |
 |
0.04 |
0.12 |
0.09 |
0.03 |
用pH大小表示溶液的酸碱性相对强弱有许多不足之处。荷兰科学家Henk Van Lubeck 引入了酸度(AG)的概念,即把酸度定义为c( H+ )与c( OH-)比值的对数,用公式表示为AG = lg[c( H+ )/c( OH-)] 。下列有关叙述中,正确的是()
| A.在25℃时,AG = 10的溶液呈碱性 |
| B.在25℃时,若溶液呈中性,则pH =7,AG = 1 |
| C.在25℃时,溶液的pH与AG的换算公式为AG = 2(7-pH) |
| D.在25℃时,0.1 mo1·L—1 NaOH溶液AG = 0 |
某二元酸(简写为H2A)溶液,按下式电离: H2A=H++HA- HA- H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:()
H++A2-,已知常温下浓度为0.1mol/L的H2A溶液中c(H+)=0.11mol/L,则关于0.1mol/L的NaHA溶液的下列叙述中正确的是:()
A.溶液肯定不显中性,但显酸性还是碱性无法确定
B.常温下0.1mol/L的NaHA溶液的PH=2
C.溶液中c(Na+)=c(HA-)+ c(A2-)
D.溶液中c(Na+)>c(HA-)>c(A2-)>c(H+)
若溶液中由水电离产生的c(OH‑)=1×10-14mol/L,满足此条件的溶液中一定能大量共存的离子组是()
| A.Al3+、Na+、NO3-、Cl- | B.K+、Na+、Cl-、Br- |
| C.K+、Na+、Cl-、CO32- | D.K+、NH4+、SO42-、NO3- |
若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈碱性,其原因可能是()
| A.生成了一种强酸弱碱盐 | B.弱酸溶液和强碱溶液反应 |
| C.强酸溶液和弱碱溶液反应 | D.一元强酸溶液和二元强碱溶液反应、 |